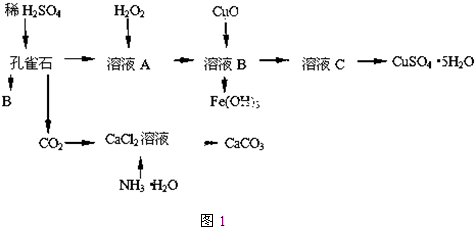
题目内容
现有CH4和O2两种气体,它们的相对分子质量之比为 ,在标准状况下的密度之比是 ,若各取16g,则物质的量依次 、 ,由此可见,当两种气体的质量相同时,它们的分子数和相对分子质量成 (正、反)比.
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:相对分子量之比为16:32;在标准状况下的密度之比等于相对分子量之比;根据公式n=
;当两种气体的质量相同时,它们的分子数和相对分子质量成反比.
| m |
| M |
解答:
解:相对分子量之比为16:32=1:2;在标准状况下的密度之比等于1:2;根据公式各16g,CH4和O2两种气体,n(CH4)=
=
=1mol,n(O2)=
=
=0.5mol;当两种气体的质量相同时,它们的分子数和相对分子质量成反比,
故答案为:1:2;1:2;1mol、0.5mol;反.
| m |
| M |
| 16g |
| 16g/mol |
| m |
| M |
| 16g |
| 32g/mol |
故答案为:1:2;1:2;1mol、0.5mol;反.
点评:本题综合考查物质的量的计算,侧重于学生的计算能力的考查,注意把握相关计算公式列式解答该题,难度不大.

练习册系列答案
相关题目
下列事实一定能证明HNO2是弱电解质的是( )
| A、常温下HNO2溶液的pH小于7 |
| B、用HNO2溶液做导电实验,灯泡很暗 |
| C、HNO2和NaCl溶液不能发生反应 |
| D、用1L0.1 mol/L HNO2溶液和2L0.1mol/LNaOH溶液做导电实验,后者灯泡更亮 |
某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-.分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A、Ba2+ |
| B、NH4+ |
| C、K+ |
| D、SO42- |
下列说法中错误的是( )
| A、CO2、SO3都是极性分子 |
| B、KF是离子化合物,HF为共价化合物 |
| C、在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D、PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、氮气的摩尔质量等于NA个N2分子的相对分子质量之和 |
| B、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| C、NA个氮气分子与NA个一氧化碳分子的质量比是1:1 |
| D、1.8gNH4+中含有的质子数为NA |