题目内容
下列事实一定能证明HNO2是弱电解质的是( )
| A、常温下HNO2溶液的pH小于7 |
| B、用HNO2溶液做导电实验,灯泡很暗 |
| C、HNO2和NaCl溶液不能发生反应 |
| D、用1L0.1 mol/L HNO2溶液和2L0.1mol/LNaOH溶液做导电实验,后者灯泡更亮 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:酸的通性不能说明酸的电离程度,利用酸不能完全电离、盐类水解的规律等、做对比实验来分析HNO2是弱电解质.
解答:
解:HNO2是酸,故溶液的pH小于7,与电解质的强弱无关,故A错误;
B.溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HNO2是弱电解质,故B错误;
C.HNO2和NaCl溶液不能发生反应与电解质的强弱无关,如硝酸也不能和氯化钠反应,故C错误;
D.0.1 mol/L HNO2溶液和0.1mol/LNaOH溶液做导电实验,后者灯泡更亮,说明HNO2中的离子浓度比氢氧化钠中的小,说明HNO2是部分电离的,是弱电解质,故D正确,
故选D.
B.溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明HNO2是弱电解质,故B错误;
C.HNO2和NaCl溶液不能发生反应与电解质的强弱无关,如硝酸也不能和氯化钠反应,故C错误;
D.0.1 mol/L HNO2溶液和0.1mol/LNaOH溶液做导电实验,后者灯泡更亮,说明HNO2中的离子浓度比氢氧化钠中的小,说明HNO2是部分电离的,是弱电解质,故D正确,
故选D.
点评:本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,注意常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
当金属钠着火时应选用的灭火剂是( )
| A、水 | B、泡沫灭火剂 |
| C、沙土 | D、煤油 |
下列叙述正确的是( )
| A、在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B、没有单质参加的反应一定不是氧化还原反应 |
| C、置换反应一定是氧化还原反应 |
| D、较难失去电子的原子,容易得到电子 |
下列变化属于物理变化的是( )
| A、电解质溶液的导电 |
| B、石油裂解 |
| C、煤的干馏 |
| D、四氯化碳萃取碘水中的I2 |
某固态化合物X不导电,但其熔化或溶于水时都能完全电离.下列关于物质X的说法中,正确的是( )
| A、X为非电解质 |
| B、X是弱电解质 |
| C、X是强电解质 |
| D、X为易溶性盐 |
乙酸的下列性质中,可以证明它是弱电解质的是( )
| A、乙酸能与水以任意比互溶 |
| B、0.1mol/L乙酸溶液的pH值约为3 |
| C、10mL 1mol/L乙酸恰好与10mL 1mol/L NaOH溶液完全反应 |
| D、乙酸溶液导电性很弱 |
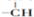 和一个
和一个 .则该有机物可能的结构有(不考虑立体异构)( )
.则该有机物可能的结构有(不考虑立体异构)( )