题目内容
4.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型.下列分子都属于含极性键的非极性分子的是( )| A. | CO2 H2O | B. | NH3 BCl3 | C. | P4 CH4 | D. | CS2 BF3 |
分析 一般来说,活泼金属与非金属形成离子键,同种非金属之间形成非极性共价键,不同非金属元素之间形成极性共价键,极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子,反之由极性键构成的结构对称的分子为非极性分子,据此判断.
解答 解:A.二氧化碳结构为O=C=O,结构对称,正负电荷的中心重为合,属于非极性分子,H2O为V形分子,结构不对称,正负电荷的中心不重合,属于极性分子,故A不选;
B.NH3为三角锥形,结构不对称,正负电荷的中心不重合,属于极性分子,BCl3分子,为正三角形,结构对称,正负电荷的中心重合,属于非极性分子,故B不选;
C.P4为正四面体形,结构对称,正负电荷的中心重合,属于由非极性键构成的非标极性分子,CH4为正四面体结构,结构对称,正负电荷的中心重合,属于非极性分子,故C不选;
D.二硫化碳结构为S=C=S,结构对称,正负电荷的中心重为合,属于极性键构成的非极性分子,BF3分子,为正三角形,结构对称,正负电荷的中心重合,属于极性键构成的非极性分子,故D选.
故选D.
点评 本题考查极性分子和非极性分子,熟悉常见元素之间的成键是解答本题的关键,注意化学键与分子的极性的关系来分析解答即可,难度不大.

练习册系列答案
相关题目
14.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L水中含有的氢氧键数为NA | |
| B. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| C. | 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA | |
| D. | 在反应2Na2O2+2CO2═2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA |
15. 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示,下列说法中不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示,下列说法中不正确的是( )
 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示,下列说法中不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示,下列说法中不正确的是( )| A. | 足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O═2HIO3+10HCl | |
| B. | 途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA | |
| C. | 用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝 | |
| D. | 由图可知氧化性的强弱顺序为Cl2>I2>IO${\;}_{3}^{-}$ |
12.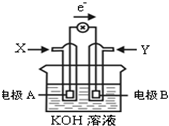 如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )
如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )
 如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )
如图为某种甲醇燃料电池示意图,工作时电子流向如图所示.下列判断正确的是( )| A. | X为氧气 | |
| B. | 电极A反应式:CH3OH-6e-+H2O=CO2+6H+ | |
| C. | B电极附近溶液pH增大 | |
| D. | 电池工作时,溶液中电子由电极B流向电极A |
19.下列烷烃进行一氯取代后,只能生成三种沸点不同的产物的是( )
| A. | CH3CH2CH3 | B. | CH3CH3 | ||
| C. | CH3C H2CH2 CH2CH3 | D. | CH3C H2CH2CH3 |
9.下列关于物质性质的说法不合理的是( )
| A. | 金属Mg与稀硫酸和CO2均能反应,其反应类型相同 | |
| B. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| C. | SO2气体通入紫色石蕊试液中,溶液先变红后褪色 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
16.下列关于元素周期表的说法正确的是( )
| A. | 18个纵行代表18个族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
14.设 NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 一定条件下,2molSO2和1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8分子中含S-S 键为7NA 个,12 克金刚石含C-C 键为4NA 个 | |
| C. | 由1molCH3COONa 和少量CH3COOH 形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 同温同压下,C18O 与N2的密度不相同 |