题目内容
2.根据下列几种物质的熔点和沸点数据,判断下列有关说法中,错误的是( )(注:AlCl3熔点在2.02×105Pa条件下测定)| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2300 |
| 沸点/℃ | 1465 | 1418 | 182.7 | 57 | 2500 |
| A. | SiCl4是分子晶体 | B. | MgCl2所含离子键的强度比NaCl大 | ||
| C. | AlCl3加热能升华 | D. | 单质B是原子晶体 |
分析 A、根据SiCl4的物理性质分析;
B、离子晶体的离子键越强,熔沸点越高;
C、由表中数据可知AlCl3的沸点低是分子晶体;
D、根据单质B的熔沸点高,可以判断B是原子晶体.
解答 解:A、由表中数据可知,SiCl4的熔沸点较低,属于分子晶体,故A正确;
B、离子晶体的离子键越强,熔沸点越高,由表中数据可知,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,故B错误;
C、由表中数据可知AlCl3的沸点低是分子晶体,加热是分子间作用力的改变,所以AlCl3加热能升华,故C正确;
D、单质B的熔沸点很高,所以单质B是原子晶体,故D正确;
故选B.
点评 本题主要考查了不同类型晶体的熔沸点高低及决定熔沸点的因素,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
4.某有机化合物的结构简式如图所示,关于该化合物的下列说法正确的是( )


| A. | 由于含有氧元素不是有机物 | |
| B. | 完全燃烧时只有二氧化碳和水两种产物 | |
| C. | 属于醇 | |
| D. | 不能使溴水褪色 |
17.能正确表示下列反应的离子方程式的是( )
| A. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| C. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
7.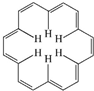 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )
 早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )
早在40年前,科学大师Heilbronner经过理论研究预测,应当有可能合成“莫比乌斯”形状的芳香族(大环)轮烯分子,这一预测被德国化学家合成证实.[18]-轮烯是一种大环轮烯,其结构简式如图所示.有关它的说法正确的是( )| A. | [18]-轮烯分子中所有原子不可能处于同一平面 | |
| B. | [18]-轮烯是芳香族化合物 | |
| C. | 1 mol[18]-轮烯最多可与9 mol氢气发生加成反应生成环烷烃 | |
| D. | [18]-轮烯与乙烯互为同系物 |
11.下列所述有机物中同分异构体种数最少的是(不考虑立体异构)( )
| 分子式 | 满足条件 | |
| A | C3H8O | 能与金属钠反应 |
| B | C5H8O4 | 有2个-COOH |
| C | C3H6O2 | 能水解 |
| D | C4H10O | 有3个甲基的醇 |
| A. | A | B. | B | C. | C | D. | D |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下1 L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1 mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24 L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
 具有水果香味的中性物质A可以发生下列变化:
具有水果香味的中性物质A可以发生下列变化: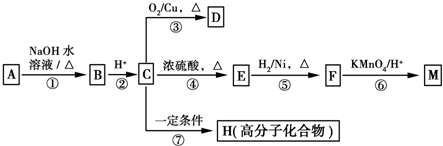
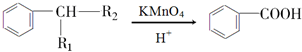 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)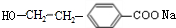 .
.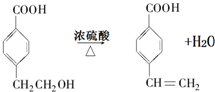 .
. .
.