题目内容
19.填“>”或“<”.(1)稳定性强弱:HF>HCl>HBr>HI
(2)碱性强弱:KOH>NaOH>Mg(OH)2.
分析 (1)元素的非金属性越强,其氢化物的稳定性越强;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:(1)元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br>I,所以氢化物的稳定性HF>HCl>HBr>HI,故答案为:>;>;>;
(2)元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg,所以碱性强弱:KOH>NaOH>Mg(OH)2,
故答案为:>;>.
点评 本题考查元素周期律,为高频考点,侧重考查学生知识综合应用能力,明确同一周期、同一主族元素原子结构和元素性质递变规律是解本题关键,熟练掌握元素周期律并灵活运用,题目难度不大.

练习册系列答案
相关题目
9.下列表述正确的是( )
| A. | c(OH-)/c(H+)═10-12的溶液中:NH4+、Cu2+、NO3-、Cl-能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
7.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为Br.
;元素⑩名称为Br.
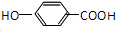
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: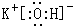 .
.
(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
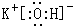 .
.(3)元素⑤与⑦形成化合物的化学式为AlCl3;实验测得,当此化合物在液态或固态时不导电,溶解于水时能导电,由此判断该化合物属于共价化合物.
(4)元素③、⑥、⑦形成的气态氢化物中,沸点最高的物质的化学式是H2O,原因是H2O分子间含有氢键.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
11.下列说法中正确的是( )
| A. | .苯及其同系物没有官能团 | B. | 卤代烃中至少含有3种元素 | ||
| C. | .醛的官能团为CHO- | D. | 羧酸和酯的官能团相同 |
8.已知还原性I->Fe2+>Br-,下列离子方程式正确的是( )
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
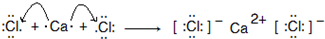 .
.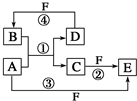 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.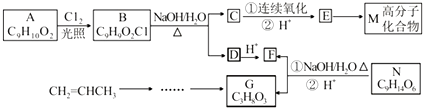
 .
. .
. .
.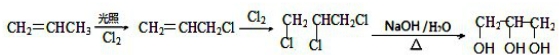 .
.
 +
+ →
→
 ,C:CH2=CHCOOCH3,D:
,C:CH2=CHCOOCH3,D: ,E:C18H37OH.
,E:C18H37OH.