题目内容
填写下列空白
(1)NaHSO4在溶液中的电离方程式为:
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为
(3)向NaHCO3溶液中滴加过量的Ca(OH)2溶液,其离子方程式为
(4)向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量可以是 mol
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式) .
(1)NaHSO4在溶液中的电离方程式为:
(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为
(3)向NaHCO3溶液中滴加过量的Ca(OH)2溶液,其离子方程式为
(4)向20mL 0.1mol/L的Ba(OH)2溶液中通入CO2,当得到0.001molBaCO3沉淀时,通入CO2的物质的量可以是
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)
考点:离子方程式的书写,电离方程式的书写
专题:离子反应专题
分析:(1)硫酸氢钠为强电解质,在溶液中完全电离出钠离子、氢离子和硫酸根离子;
(2)硫酸氢钠与氢氧化钡按照物质的量2:1反应生成硫酸钡和水,溶液显示中性,据此写出反应的离子方程式;
(3)氢氧化钙过量,离子方程式按照碳酸氢钠的化学式组成书写;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况;
(5)反应物为二氧化硫、高锰酸根离子和水,生成为镁离子、硫酸根离子和氢离子,根据化合价升降相等配平反应的离子方程式.
(2)硫酸氢钠与氢氧化钡按照物质的量2:1反应生成硫酸钡和水,溶液显示中性,据此写出反应的离子方程式;
(3)氢氧化钙过量,离子方程式按照碳酸氢钠的化学式组成书写;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况;
(5)反应物为二氧化硫、高锰酸根离子和水,生成为镁离子、硫酸根离子和氢离子,根据化合价升降相等配平反应的离子方程式.
解答:
解:(1)硫酸氢钠在溶液中完全电离,其电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)硫酸氢钠与氢氧化钡反应生成硫酸钡和水,当氢离子与氢氧根离子恰好反应时,溶液显示中性,反应的离子方程式为:Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O,
故答案为:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O;
(3)氢氧化钙过量,反应生成碳酸钙和水,反应的离子方程式为:HCO3-+Ca2++OH-=H2O+CaCO3↓,故答案为:HCO3-+Ca2++OH-=H2O+CaCO3↓;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况,若二氧化碳不足,则n(CO2)=n(BaCO3)=0.001mol,若二氧化碳过量,则n(CO2)=0.002mol+0.001mol=0.003mol,
故答案为:0.001或0.003;
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰,化合价有+7变为+2,化合价降低5价;二氧化硫被氧化成硫酸,化合价有+4变为+6,化合价升高2价,根据化合价升降相等配平,则反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
(2)硫酸氢钠与氢氧化钡反应生成硫酸钡和水,当氢离子与氢氧根离子恰好反应时,溶液显示中性,反应的离子方程式为:Ba2++SO42-+2OH--+2H+=BaSO4↓+2H2O,
故答案为:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O;
(3)氢氧化钙过量,反应生成碳酸钙和水,反应的离子方程式为:HCO3-+Ca2++OH-=H2O+CaCO3↓,故答案为:HCO3-+Ca2++OH-=H2O+CaCO3↓;
(4)n[Ba(OH)2]=0.002mol,得到0.001molBaCO3沉淀时,有二氧化碳不足与过量两种情况,若二氧化碳不足,则n(CO2)=n(BaCO3)=0.001mol,若二氧化碳过量,则n(CO2)=0.002mol+0.001mol=0.003mol,
故答案为:0.001或0.003;
(5)向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰,化合价有+7变为+2,化合价降低5价;二氧化硫被氧化成硫酸,化合价有+4变为+6,化合价升高2价,根据化合价升降相等配平,则反应的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,
故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
点评:本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,如难溶物、弱电解质等需要保留化学式,必须遵循守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
将少量固体分别投入到盛少量水的烧杯中,再滴入酚酞,溶液不会变为红色的是( )
| A、Na |
| B、Na2O |
| C、Na2CO3 |
| D、NaCl |
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN-N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出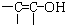 结构的物质)
结构的物质) 分子中最多有
分子中最多有