题目内容
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
| A、取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| B、取a克混合物与足量稀硫酸充分反应,逸出气体未经干燥用碱石灰吸收,增重b克 |
| C、取a克混合物充分加热至恒重,减重b克 |
| D、取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
考点:化学实验方案的评价,钠的重要化合物,探究物质的组成或测量物质的含量
专题:几种重要的金属及其化合物
分析:实验方案是否可行,关键看根据测量数据能否计算出结果.
A.根据钠守恒,可列方程组求解;
B.应先把水蒸气排除才合理;
C.此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
D.根据质量关系,可列方程组求解.
A.根据钠守恒,可列方程组求解;
B.应先把水蒸气排除才合理;
C.此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
D.根据质量关系,可列方程组求解.
解答:
解:A.Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,故A不选;
B.混合物与足量稀硫酸充分反应,也会生成水和二氧化碳,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故B选;
C.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故C不选;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D不选.
故选B.
B.混合物与足量稀硫酸充分反应,也会生成水和二氧化碳,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故B选;
C.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故C不选;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D不选.
故选B.
点评:本题考查物质含量的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握物质的性质以及实验方案的原理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将少量固体分别投入到盛少量水的烧杯中,再滴入酚酞,溶液不会变为红色的是( )
| A、Na |
| B、Na2O |
| C、Na2CO3 |
| D、NaCl |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1.7 g H2O2中含有的电子数为0.9NA |
| B、等物质的量的N2和CO所含分子数均为NA |
| C、1 mol Na2O2固体中含离子总数为4NA |
| D、在18 g 18O2中含有2NA个氧原子 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、K+、Fe2+、NO3-、Cl- |
| B、Al3+、Na+、CO32-、NO3- |
| C、NH4+、K+、NO3-、Cl- |
| D、Na+、Ba2+、Cl-、SO42- |
下列说法中正确的是( )
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、生成物中全部化学键在形成时所释放的能量大于破坏反应物中全部化学键所吸收的能量时,反应为吸热反应 |
| C、为了提高煤的利用率,常将煤气化或液化后燃烧.煤气化或液化属于物理变化 |
| D、反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 |
最近医学界通过放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下通过断裂DNA杀死细胞,从而抑制艾滋病,则有关14C的叙述正确的是( )
| A、与C60中普通碳原子的化学性质不同 |
| B、与16O含有的中子数相同 |
| C、是C60的同素异形体 |
| D、与14N互为同位素 |
下列操作会使H2O的电离平衡向电离方向移动,且pH<7的是( )
| A、向水中加少量Na2CO3 |
| B、向水中加少量NaOH |
| C、向水中加少量NaHSO4 |
| D、将纯水加热到90℃ |
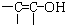 结构的物质)
结构的物质)