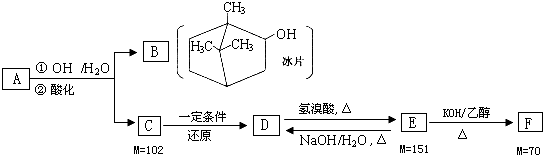
题目内容
标准状况下,11.2L的氯化氢气体(HCl),完全溶解于水中,形成500ml的溶液.
计算(1)氯化氢气体的物质的量是?
(2)形成溶液的溶质的物质的量浓度是多少?
(3)取出100ml溶液,则此时取出液中的溶质的质量为多少?
计算(1)氯化氢气体的物质的量是?
(2)形成溶液的溶质的物质的量浓度是多少?
(3)取出100ml溶液,则此时取出液中的溶质的质量为多少?
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)气体的物质的量根据n=
来计算;
(2)根据C=
来计算溶液的物质的量浓度;
(3)溶液是均一的稳定的,取出一部分溶液后,浓度不变,根据n=CV和m=nM来计算.
| V |
| Vm |
(2)根据C=
| n |
| V |
(3)溶液是均一的稳定的,取出一部分溶液后,浓度不变,根据n=CV和m=nM来计算.
解答:
解:(1)标况下,11.2LHCl气体的物质的量根据n=
=
=0.5mol,
答:氯化氢气体的物质的量是0.5mol;
(2)溶液的物质的量浓度C=
=
=1mol/L,
答:形成溶液的溶质的物质的量浓度是1mol/L;
(3)溶液是均一的稳定的,取出一部分溶液后,浓度不变,即取出的100mL溶液的浓度仍为1mol/L,
根据n=CV可知取出的溶液中溶质的物质的量n=1mol/L×0.1L=0.1mol,
溶质的质量m=nM=0.1mol×36.5g/mol=3.65g,
答:取出100ml溶液,则此时取出液中的溶质的质量为3.65g.
| V |
| Vm |
| 11.2L |
| 22.4L/mol |
答:氯化氢气体的物质的量是0.5mol;
(2)溶液的物质的量浓度C=
| n |
| V |
| 0.5mol |
| 0.5L |
答:形成溶液的溶质的物质的量浓度是1mol/L;
(3)溶液是均一的稳定的,取出一部分溶液后,浓度不变,即取出的100mL溶液的浓度仍为1mol/L,
根据n=CV可知取出的溶液中溶质的物质的量n=1mol/L×0.1L=0.1mol,
溶质的质量m=nM=0.1mol×36.5g/mol=3.65g,
答:取出100ml溶液,则此时取出液中的溶质的质量为3.65g.
点评:本题考查了物质的量浓度的计算,涉及公式n=
和c=
的综合应用,题目难度不大,注意物质的量变化与化学计量数的正比关系.
| V |
| Vm |
| n |
| V |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的( )
| A、升高温度有利于反应速率增加,从而缩短达到平衡的时间升高温度 |
| B、正向反应速率增加,逆向反应速率减小 |
| C、达到平衡后,升高温度,平衡向正反应方向移动 |
| D、达到平衡后,减小压强,平衡向正反应方向移动 |
下列离子方程式中正确的是( )
| A、稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| B、硝酸银溶液与食盐水的反应:Ag++Cl-═AgCl↓ |
| C、锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ |
| D、氧化铜与稀硫酸的反应:CuO+2H++SO42-═CuSO4+H2O |
下列离子方程式的书写正确的是( )
| A、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++2H2O+NO↑ |
| B、将少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO |
| C、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4+H2O |
| D、向Mg(OH)2浊液中滴入FeCl3溶液:3 Mg(OH)2(s)+2 Fe3+?2 Fe(OH)3(s)+3Mg2+ |
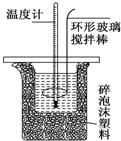 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.