题目内容
在2L的密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),5min后还反应达到平衡,测得此时CO的物质的量为0.5mol.试回答下列问题:
(1)用CO表示达到平衡时该反应的平均速率为 .
(2)该反应的化学平衡常数为 .
(3)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (选填“增大”、“减小”或“不变”).
(4)若427℃时该反应的平衡常数为9.4,判断该反应的△H 0(选填“大于”、“小于”或“等于”).
(1)用CO表示达到平衡时该反应的平均速率为
(2)该反应的化学平衡常数为
(3)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将
(4)若427℃时该反应的平衡常数为9.4,判断该反应的△H
考点:化学平衡的计算
专题:
分析:根据反应的方程式H2O (g)+CO (g)?H2(g)+CO2 (g),分别计算起始、转化以及平衡时的物质的量,
(1)利用V=
可计算出用CO表示达到平衡时该反应的平均速率;
(2)利用K=
该反应的平衡常数;
(3)利用平衡移动判断CO的转化率;
(4)根据温度变化时平衡常数的变化可判断反应热.
(1)利用V=
| △c |
| △t |
(2)利用K=
| C(CO 2)C(H 2) |
| C(CO)C(H 2O) |
(3)利用平衡移动判断CO的转化率;
(4)根据温度变化时平衡常数的变化可判断反应热.
解答:
解:H2O (g)+CO (g)?H2(g)+CO2 (g)
起始:1 1 0 0
变化:0.5 0.5 0.5 0.5
平衡:0.5 0.5 0.5 0.5
(1)则用CO表示达到平衡时该反应的平均速率为
=0.05mol/(L?min),故答案为:0.05mol/(L?min);
(2)800℃该反应的平衡常数k=
=1,故答案为:1;
(3)如果继续向该平衡体系中通入1.0mol的H2O(g),平衡向正反应方向移动,故平衡时CO的转化率增大,故答案为:增大;
(4)427℃时该反应的平衡常数为9.4,若保持其他条件不变,将温度从800℃降到427℃,平衡常数增加意味着反应正向移动,说明正反应放热,则该反应的△H<0,
故答案为:<.
起始:1 1 0 0
变化:0.5 0.5 0.5 0.5
平衡:0.5 0.5 0.5 0.5
(1)则用CO表示达到平衡时该反应的平均速率为
| ||
| 5min |
(2)800℃该反应的平衡常数k=
| 0.5×0.5 |
| 0.5×0.5 |
(3)如果继续向该平衡体系中通入1.0mol的H2O(g),平衡向正反应方向移动,故平衡时CO的转化率增大,故答案为:增大;
(4)427℃时该反应的平衡常数为9.4,若保持其他条件不变,将温度从800℃降到427℃,平衡常数增加意味着反应正向移动,说明正反应放热,则该反应的△H<0,
故答案为:<.
点评:本题考查化学平衡的计算,题目难度中等,本题注意根据物质的量的变化利用三段式法解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于摩尔的说法中正确的为( )
| A、摩尔是表示物质数量的单位 |
| B、摩尔是表示物质多少的单位 |
| C、摩尔是表示物质的量的单位 |
| D、摩尔是表示物质的质量的单位 |
下列实验操作正确的是( )
A、 制氨气 |
B、 收集CO2或NO |
C、 配制稀硫酸 |
D、 氨气的吸收 |
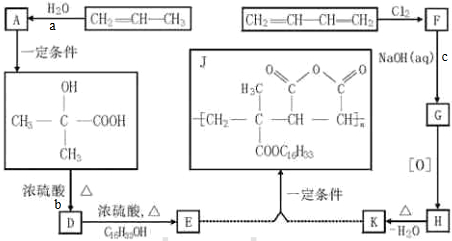
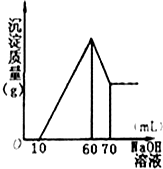 有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
有一无色透明的溶液,只可能含有NH4+、Fe3+、Ba2+、H+、Mg2+、Al3+、SO42-、CO32-离子中的某几种,现分别取溶液进行下列实验:
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
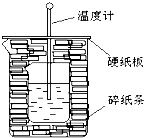 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: