题目内容
【化学与技术】我国规定饮用水质量标准必须符合下表所示要求:
下图是源水处理成自来水的工艺流程示意图.
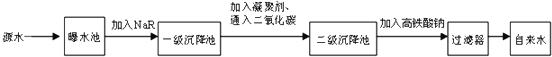
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,离子交换法是用离子交换剂软化水的方法.现在常用作离子交换剂的离子交换树脂,是一类不溶于水但能与溶液中相同电性离子进行交换的有机高分子电解质,常用NaR、HR表示.写出用NaR 软化水的过程:
(2)FeSO4?7H2O来源充足,是常用的凝聚剂.它在水中最终生成胶状Fe(OH)3沉淀.凝聚剂除去悬浮固体颗粒的过程 (填写编号) ①只是物理过程;②只是化学过程;③是物理和化学过程.
(3)高铁酸钠(Na2FeO4)是一种新型水处理剂,它可以代替氯气,在水中反应被还原为Fe3+. 高铁酸钠能消毒杀菌,这是基于它的 性质;
高铁酸钠用于水处理,除了能消毒杀菌外,它还能沉降水中的悬浮杂质,起到净水作用,请说明其净水原理: ;
写出氯气氧化Fe(OH)3为Na2FeO4的化学方程式: .
| 项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
| 相关值 | 6.5~8.5 | <0.0045mol?L-1 | <100个?mL-1 |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,离子交换法是用离子交换剂软化水的方法.现在常用作离子交换剂的离子交换树脂,是一类不溶于水但能与溶液中相同电性离子进行交换的有机高分子电解质,常用NaR、HR表示.写出用NaR 软化水的过程:
(2)FeSO4?7H2O来源充足,是常用的凝聚剂.它在水中最终生成胶状Fe(OH)3沉淀.凝聚剂除去悬浮固体颗粒的过程
(3)高铁酸钠(Na2FeO4)是一种新型水处理剂,它可以代替氯气,在水中反应被还原为Fe3+. 高铁酸钠能消毒杀菌,这是基于它的
高铁酸钠用于水处理,除了能消毒杀菌外,它还能沉降水中的悬浮杂质,起到净水作用,请说明其净水原理:
写出氯气氧化Fe(OH)3为Na2FeO4的化学方程式:
考点:盐类水解的应用,氧化还原反应,物质分离和提纯的方法和基本操作综合应用
专题:元素及其化合物
分析:(1)根据阳离子交换树脂可以实现阳离子之间的交换,阳离子交换树脂交换出阳离子;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,生成胶状Fe(OH)3沉淀具有吸附性;
(3)高铁酸钠中铁元素处于+7价,所以高铁酸钠具有强氧化性,还原产物是Fe3+,Fe3+可发生水解,生成Fe(OH)3胶体,能净水;氯气具有氧化性,在碱性环境下能将铁离子氧化为高铁酸根离子,本身被还原为氯离子,据此书写离子方程式即可.
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,生成胶状Fe(OH)3沉淀具有吸附性;
(3)高铁酸钠中铁元素处于+7价,所以高铁酸钠具有强氧化性,还原产物是Fe3+,Fe3+可发生水解,生成Fe(OH)3胶体,能净水;氯气具有氧化性,在碱性环境下能将铁离子氧化为高铁酸根离子,本身被还原为氯离子,据此书写离子方程式即可.
解答:
解:(1)用NaR 软化水的过程,是Ca2+、Mg2+跟Na+发生交换作用,发生2NaR+Ca2+=CaR2+2Na+、2NaR+Mg2+=Mg R2+2Na+;
故答案为:2NaR+Ca2+=CaR2+2Na+、2NaR+Mg2+=MgR2+2Na+;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,为化学变化,而生成胶状Fe(OH)3沉淀具有吸附性,除去悬浮固体颗粒为物理变化,故答案为:③;
(3)高铁酸钠中铁元素处于+7价,所以高铁酸钠具有强氧化性,能消毒杀菌,高铁酸钠用于水处理时,可以和水反应得到还原产物Fe3+,Fe3+可发生水解,生成 Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果,氯气具有氧化性,在碱性环境下能将铁离子氧化为高铁酸根离子,本身被还原为氯离子,氯气氧化Fe(OH)3为Na2FeO4的化学方程式为:2Fe(OH)3+3Cl2+10 NaOH=2Na2FeO4+8H2O+6NaCl,
故答案为:强氧化性;高铁酸钠的还原产物是Fe3+,Fe3+可发生水解,生成 Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果;2Fe(OH)3+3Cl2+10 NaOH=2Na2FeO4+8H2O+6NaCl.
故答案为:2NaR+Ca2+=CaR2+2Na+、2NaR+Mg2+=MgR2+2Na+;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,为化学变化,而生成胶状Fe(OH)3沉淀具有吸附性,除去悬浮固体颗粒为物理变化,故答案为:③;
(3)高铁酸钠中铁元素处于+7价,所以高铁酸钠具有强氧化性,能消毒杀菌,高铁酸钠用于水处理时,可以和水反应得到还原产物Fe3+,Fe3+可发生水解,生成 Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果,氯气具有氧化性,在碱性环境下能将铁离子氧化为高铁酸根离子,本身被还原为氯离子,氯气氧化Fe(OH)3为Na2FeO4的化学方程式为:2Fe(OH)3+3Cl2+10 NaOH=2Na2FeO4+8H2O+6NaCl,
故答案为:强氧化性;高铁酸钠的还原产物是Fe3+,Fe3+可发生水解,生成 Fe(OH)3胶体,它可吸附水中悬浮的杂质或泥沙胶粒等一起凝聚而沉降,达到净水的效果;2Fe(OH)3+3Cl2+10 NaOH=2Na2FeO4+8H2O+6NaCl.
点评:本题考查物质的分离、提纯实验方案的设计、盐的水解原理的应用以及氧化还原反应的知识,为高频考点,明确净化原理及各物质的性质、发生的化学反应是解答本题的关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论.以下几个类比推理结论中正确的是( )
| A、CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成 |
| B、在常温下,Na2CO3+2HCl═2NaCl+CO2↑+H2O,说明HCl酸性强于H2CO3;在高温下,Na2CO3+SiO2═Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 |
| C、H2SO4为强酸,推出HClO4为强酸 |
| D、NH3的沸点高于PH3,推出CH4沸点高于SiH4 |
若m g氢气中含n个氢原子,则阿伏加德罗常数是( )
| A、2n | ||
B、
| ||
C、
| ||
| D、n |
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
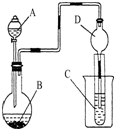

| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、实验仪器D主要起到洗气的作用 |
| D、若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
(双选)常温下,下列各组离子一定可以大量共存的是( )
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |

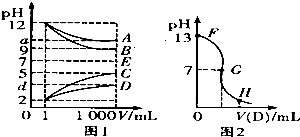 物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:
物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答: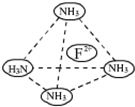 物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.