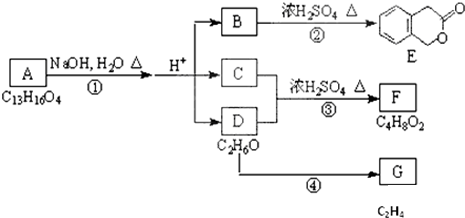
题目内容
0.2mol有机物A和0.4molO2在密闭容器中燃烧后产物为CO2、CO和H2O(g),产物经过浓H2SO4,质量增加10.8;再通过灼热CuO,充分反应后,固体质量减轻3.2g,最后气体再通过碱石灰被完全吸收,质量增加17.6g,试推断该有机物A的分子式和相对分子质量.若0.2molA恰好与9.2g 金属钠完全反应,试确定该有机物的结构简式并命名.
考点:有机物的推断,有机化合物命名
专题:烃及其衍生物的燃烧规律
分析:浓硫酸增重10.8g为反应生成的水的质量,通过灼热CuO,由于发生反应CuO+CO
Cu+CO2,固体质量减轻了3.2g,结合固体质量变化利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了17.6g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中A分子中C、H、O原子数目,进而求得化学式;结合分子式、有机物A与钠反应判断分子中官能团,据此书写结构简式.
| ||
解答:
解:有机物燃烧生成水10.8g,物质的量为
=0.6mol,
令有机物燃烧生成的CO为x,则:
CuO+CO
Cu+CO2 固体减少△m
28g 16g
x 3.2g
所以x=
=5.6g,CO的物质的量为
=0.2mol,
CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g,
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,其物质的量为
=0.2mol,
根据氧元素守恒可知,0.2molA中O原子物质的量为0.2mol+0.2mol×2+0.6mol-0.4mol×2=0.4mol,
有机物A分子中N(C)=
=2、N(H)=
=6、N(O)=
=2,所以有机物A的分子式为C2H6O2,相对分子质量为12×2+6+16×2=62,
若0.2molA恰好与9.2g 金属钠完全反应,钠的物质的量为
=0.2mol,则有机物分子中含有羟2个-OH,该有机物的结构简式为HOCH2CH2OH,名称为乙二醇,
答:有机物A的分子式为C2H6O2,相对分子质量为62,结构简式为HOCH2CH2OH,名称为乙二醇.
| 10.8g |
| 18g/mol |
令有机物燃烧生成的CO为x,则:
CuO+CO
| ||
28g 16g
x 3.2g
所以x=
| 28g×3.2g |
| 16g |
| 5.6g |
| 28g/mol |
CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g,
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,其物质的量为
| 8.8g |
| 44g/mol |
根据氧元素守恒可知,0.2molA中O原子物质的量为0.2mol+0.2mol×2+0.6mol-0.4mol×2=0.4mol,
有机物A分子中N(C)=
| 0.2mol+0.2mol |
| 0.2mol |
| 0.6mol×2 |
| 0.2mol |
| 0.4mol |
| 0.2mol |
若0.2molA恰好与9.2g 金属钠完全反应,钠的物质的量为
| 9.2g |
| 46g/mol |
答:有机物A的分子式为C2H6O2,相对分子质量为62,结构简式为HOCH2CH2OH,名称为乙二醇.
点评:本题考查有机物推断,难度不大,掌握燃烧法利用原子守恒确定有机物的分子式.

练习册系列答案
相关题目
下列各项描述不涉及胶体知识的有( )
| A、医学上的血液透析 |
| B、清晨,在茂密的树林中,常可看到从枝叶间透过一道道光柱 |
| C、工业上生产有色玻璃 |
| D、钢铁制品在海水中比在河水中容易生锈 |
关于电解槽的叙述不正确的是( )
| A、是电能转变成化学能的装置 |
| B、与电源正极相连的是阳极 |
| C、阴极失去电子,发生氧化反应 |
| D、参与电解的阳离子移向阴极 |
下列有关“科学探究”的说法正确的是( )
| A、将打磨过的铝箔在酒精灯上加热至熔化,熔化的铝不滴落,因为铝表面生成了氧化膜 |
| B、5mL淀粉溶剂和2滴碘水,1mL稀硫酸混合,加热颜色变浅,冷却后恢复原来颜色是因为淀粉水解以及水解产物重新结合生成淀粉 |
| C、某卤代弪与NaOH溶液共热,冷却后向其中滴加AgNO3溶液,产生白色沉淀,证明该卤代颈分子中一定含有氯原子 |
| D、将Fe(OH)3胶体和泥水混合物进行过滤,可以得到Fe(OH)3固体和泥土 |