题目内容
利用Na2O2与水反应能放出氧气的性质,可通过选择图1装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数.
(1)现欲用500mL量筒进行测定,取用Na2O2样品的质量应是 (填序号).
A.0.1g~0.2g B.2.5g~3.0g C.5.0g~6.0g D.10g~15g
(2)如用托盘天平称取样品,应选用如图2中的 (填数字序号),不选用另一个装置的原因是 .
(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度降低至室温.如忽略导管本身带来的测量误差,应选用装置A、B中的 (填“A”或“B”).如果选用了另一种不适当的装置,测得的Na2O2的质量分数会 (填“偏大”或“偏小”),原因是 .
(4)如在实验中,气体摩尔体积为a L/mol,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为 %.

(1)现欲用500mL量筒进行测定,取用Na2O2样品的质量应是
A.0.1g~0.2g B.2.5g~3.0g C.5.0g~6.0g D.10g~15g
(2)如用托盘天平称取样品,应选用如图2中的
(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度降低至室温.如忽略导管本身带来的测量误差,应选用装置A、B中的
(4)如在实验中,气体摩尔体积为a L/mol,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为

考点:探究物质的组成或测量物质的含量,碱金属及其化合物的性质实验
专题:实验探究和数据处理题
分析:(1)500mL量筒量取的是过氧化钠与水反应生成氧气的体积,根据500mL氧气体积计算出过氧化钠的最大质量;
(2)过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,烧杯中过氧化钠与空气接触面过大;
(3)因Na2O2与水反应会放热而使产生的氧气体积变大,导致过氧化钠的质量分数偏大,故应冷却气体,选用长导管;
(4)量筒中收集到的液体体积即为O2的体积,根据氧气的体积计算过氧化钠的量.
(2)过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,烧杯中过氧化钠与空气接触面过大;
(3)因Na2O2与水反应会放热而使产生的氧气体积变大,导致过氧化钠的质量分数偏大,故应冷却气体,选用长导管;
(4)量筒中收集到的液体体积即为O2的体积,根据氧气的体积计算过氧化钠的量.
解答:
解:(1)500mL量筒量取的是过氧化钠与水反应生成氧气的体积,生成的500mL氧气,大约为0.022mol,根据2Na2O2+2H2O=4NaOH+O2↑,需要过氧化钠质量约为0.044mol×78g/mol=3.4g,Na2O2的质量应小于3.4g,如果过多会造成量筒中液体外溢,如果过少产生的气体太少,测量过程中量筒无法读数或误差太大,故选择Na2O2样品的合适质量为2.5g~3.0g,故答案为:B;
(2)过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,烧杯中过氧化钠与空气接触面过大,所以选择用锥形瓶称取,故答案为:①;过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量;
(3)因Na2O2与水反应会放热而使产生的氧气体积变大,导致过氧化钠的质量分数偏大,故应冷却气体,选用长导管,防止量筒的读数大于室温时放出的氧气的体积,故答案为:A;偏大;量筒的读数大于室温时放出的氧气的体积;
(4)量筒中收集到的液体体积即为O2的体积,其物质的量n(O2)=
mol,根据反应关系式:2Na2O2~O2↑,可得n(Na2O2)=
mol,Na2O2的质量分数=
×100%=
×100%,故答案为:
.
(2)过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,烧杯中过氧化钠与空气接触面过大,所以选择用锥形瓶称取,故答案为:①;过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量;
(3)因Na2O2与水反应会放热而使产生的氧气体积变大,导致过氧化钠的质量分数偏大,故应冷却气体,选用长导管,防止量筒的读数大于室温时放出的氧气的体积,故答案为:A;偏大;量筒的读数大于室温时放出的氧气的体积;
(4)量筒中收集到的液体体积即为O2的体积,其物质的量n(O2)=
| V×10-3 |
| a |
| 2V×10-3 |
| a |
| ||
| mg |
| 0.156V |
| am |
| 15.6V |
| am |
点评:本题考查了过氧化钠与水反应的性质实验以及测定物质的质量分数的实验,题目较为综合,难度不大,注意把握实验方案的设计原理.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、硫酸铁中加入少量氨水:Fe3++3OH-═Fe(OH)3↓ |
| B、电解饱和食盐水:2Cl-+2H2O=H2↑+Cl2↑+2OH- |
| C、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| D、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图: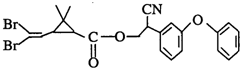 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )
 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、属于卤代烃 |
| C、在酸性和碱性条件下都不能水解 |
| D、在一定条件下可以发生加成反应 |

