题目内容
某小型氯碱厂采用电解氯化钠溶液的方法生产氯气、氢气和氢氧化钠.该工厂平 均每天生产80%的氢氧化钠15t.试问:该工厂平均每天至少需要多少吨的氯化钠?
考点:化学方程式的有关计算
专题:计算题
分析:根据化学反应方程式,将氢氧化钠的质量代入计算来求需要的氯化钠.
解答:
解:(1)设该工厂每天至少需要氯化钠的质量为x,则
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
117 80
x 80%×15t
=
,
解得x=17.55t,
答:该工厂平均每天至少需要17.55吨的氯化钠.
2NaCl+2H2O
| ||
117 80
x 80%×15t
| 117 |
| 80 |
| 80 |
| 80%×15t |
解得x=17.55t,
答:该工厂平均每天至少需要17.55吨的氯化钠.
点评:本题考查学生利用电解的化学反应方程式来计算,较简单,学生将氯化钠的质量代入化学反应方程式计算即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
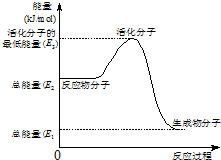 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+1/2O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A、1molCH3OH完全燃烧放出热量192.9 kJ |
| B、②中的能量变化如图所示,则Q=E3-E1 |
| C、H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D、根据②推知:在25℃,101 kPa时,1 molCH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
CS2(液)能在氧气中完全燃烧,生成CO2和SO2,若用0.1molCS2在1molO2中完全燃烧后,反应后混合物在标准状况下所占的体积为( )
| A、6.72L |
| B、13.44L |
| C、15.68L |
| D、22.4L |