题目内容
往澄清石灰水中通入过量SO2的离子方程式 .
考点:二氧化硫的化学性质
专题:氧族元素
分析:澄清石灰水中通入过量SO2,反应生成亚硫酸氢钙,以此来解答.
解答:
解:往澄清的石灰水中通入过量SO2,反应生成亚硫酸氢钙,其离子反应为OH-+SO2═HSO3-,故答案为:OH-+SO2═HSO3-.
点评:本题考查离子反应方程式的书写,为高考常见题型,注意与量有关的离子反应的生成物及书写方法即可解答,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
下表所列各组物质中,物质之间按箭头方向通过一步反应不能实现如图所示转化的是( )
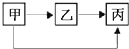

| 物质 选项 | 甲 | 乙 | 丙 |
| A | CuO | CO2 | H2O |
| B | C | CO | CO2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | H2SO4 | H2O | H2 |
| A、A | B、B | C、C | D、D |
将AgCl分别加入盛有:①5mL水;②6mL 0.5mol/L NaCl溶液;③10mL 0.3mol/L CaCl2溶液;④50mL 0.1mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是( )
| A、④③②① | B、②③④① |
| C、①④③② | D、①④②③ |
己知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17.某溶液中含有Cl-、Br-和I-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A、Cl-、Br-、I- |
| B、Br-、Cl-、I- |
| C、I-、Br-、Cl- |
| D、Br-、I-、Cl- |
 历史上最早应用的还原性染料是靛蓝,其结构简式如图.下列关于靛蓝的叙述中错误的是( )
历史上最早应用的还原性染料是靛蓝,其结构简式如图.下列关于靛蓝的叙述中错误的是( )| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质苯环上的一溴代物有两种 |
| D、1mol靛蓝最多可与9mol氢气加成 |
在常温下,PH=a的醋酸和PH=14-a的NaOH溶液等体积混合,所得溶液的下列说法正确的是( )
| A、PH<7 |
| B、PH=7 |
| C、PH>7 |
| D、上述三种均有可能 |
