题目内容
9. NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下
NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)常温时,0.1mol•L-1NH4Al(SO4)2溶液的PH=3.
①溶液的Kw=l.0×l0-14(填数值),由水电离的c(H+)=l.0×l0-3mol•L-1
②溶液中c(NH4+)+c(NH3•H2O)=c (Al3+)+c( Al(OH)3)(填“>”“=”“<.”):
2c(SO42-)-c(NH4+)-3c (Al3+)=10-3-10-11 mol•L-1(填数值).
(2)80℃时,0.1mol•L-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小.
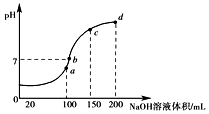
(3)常温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.
①图中a、b、c、d四个点中水的电离程度最小的是d.
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为H++OH-=H2O.
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(NH4+)>c(OH-).
分析 (1)①常温时,水的离子积常数为l.0×l0-14;0.1mol•L-1NH4Al(SO4)2溶液的PH=3是因为铵根离子和铝离子的水解;
②据物料守恒分析;根据电荷守恒计算;
(2)NH4Al(SO4)2水解,升高温度其水解程度增大;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性;
②向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应;
解答 解:(1)①常温时,水的离子积常数为l.0×l0-14;0.1mol•L-1NH4Al(SO4)2溶液的PH=3是因为铵根离子和铝离子的水解,所以由水电离的c(H+)=l.0×l0-3mol/L,
故答案为:l.0×l0-14;l.0×l0-3;
②据物料守恒,NH4Al(SO4)2中N原子与Al原子个数比为1:1,所以c(NH4+)+c(NH3•H2O)=c (Al3+)+c( Al(OH)3);根据电荷守恒得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1-10-11mol•L-1=10-3-10-11mol•L-1,
故答案为:=;10-3-10-11;
(2)NH4Al(SO4)2水解,升高温度其水解程度增大,pH减小,故答案为:NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
(3)①a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,所以d点水的电离程度最小,故答案为:d;
②向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液100mL时,仅发生氢离子和氢氧根离子的中和反应,离子方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
③NH4HSO4的电离方程式为NH4HSO4=NH4++H++SO42-,还有水的微弱电离,铵根离子因微弱水解导致浓度略有减小,所以离子浓度由大到小的顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(3)③为易错点,注意根据水的电离和铵根水解都很微弱.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
(2)A原子核外有4种能量不同的电子;写出D离子的核外电子排布式1s22s22p6.
(3)D和C形成的化合物R属于离子晶体;R的熔点高于四氯化碳,理由是R是离子晶体,固态四氟化碳是分子晶体
(4)A的金属性比D强,写出能证明该结论的一个事实金属钠能从熔融的氯化镁中置换出金属镁.
(5)设计一个简单实验,说明一水合氨是弱碱测定氯化铵溶液的pH值,测得其pH<7.
| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
| A. | 1:2 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
| A. | 单质的沸点:Z>W | |
| B. | 简单离子半径:X>W | |
| C. | 元素X与氧可形成既含离子键也含非极性共价键的化合物 | |
| D. | X、Y、Z的最高价氧化物对应的水化物能相互反应 |
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | BaCl2溶液 | D. | Ca(ClO)2溶液 |
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
