题目内容
8.“绿色试剂”双氧水既可作氧化剂,又可作还原剂.酸性高锰酸钾溶液能与双氧水发生如下反应:2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O①上述反应中,还原剂是H2O2,被还原的元素是Mn.
②用单线桥表示该反应电子转移的方向和数目:
 .
.
分析 2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O反应中氧元素化合价由-1升高为0价,Mn元素化合价由+7价降低为+2,则H2O2的为还原剂,KMnO4为氧化剂,转移电子数为10,据此分析解答.
解答 解:①2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O反应中氧元素化合价由-1升高为0价,则H2O2的为还原剂,Mn元素化合价由+7价降低为+2,则被还原的元素是Mn,故答案为:H2O2;Mn;
②2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O反应中氧元素化合价由-1升高为0价,Mn元素化合价由+7价降低为+2,转移电子数为10,用单线桥表示该反应电子转移的方向和数目为: ,
,
故答案为: .
.
点评 本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识相关概念及相关物质的性质的判断,难度不大.

练习册系列答案
相关题目
7.下列有关有机化合物的说法正确的是( )
| A. | 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯 | |
| B. | 分子式为C5H10Q2,且能与NaHCO3反应的有机物有3种 | |
| C. | 乙醇制备乙烯和乙醇制备乙酸乙酯均为取代反应 | |
| D. | 2-甲基戊烷和4-甲基戊烷互为同分异构体 |
16.下列关于有机物的说法正确的是( )
| A. | 制备CH3CHCl2:乙烷在光照条件下和氯气反应或乙烯和氯水反应 | |
| B. | 沸点和在水中的溶解度:乙醇大于乙烷 | |
| C. | 鉴别溴苯和CCl4:硝酸银溶液 | |
| D. | 除去乙酸乙酯中混有的乙酸和乙醇:NaOH溶液 |
13.下列关于物质的性质或制备说法正确的是( )
| A. | 用平行光照射氯化钠溶液和氢氧化铁胶体,产生的现象相同 | |
| B. | 铝具有较强的抗腐蚀性质,是因为铝与氧气常温下不反应 | |
| C. | 实验室用MnO2和稀盐酸反应制取氯气 | |
| D. | 工业上用电解熔融氧化铝制取金属铝 |
17.下列做法或操作中正确的是( )
①做实验时可用手直接拿取金属钠
②夜间发生厨房煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风
③不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
④进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外.
①做实验时可用手直接拿取金属钠
②夜间发生厨房煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风
③不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
④进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
18.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )


| A. | 锌电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的 c(SO42-)不变 | |
| C. | 电池工作一段时间后,乙池溶液的总质量减少 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |

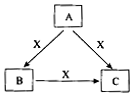 A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.