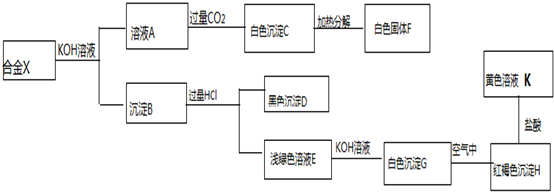
题目内容
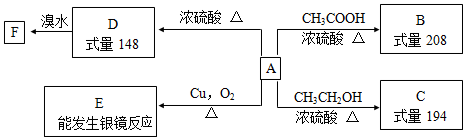
19.以苯酚为原料合成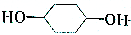 的路线如下图所示.
的路线如下图所示.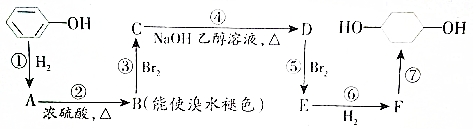
请回答下列问题:
(1)写出以下物质的结构简式:B
 ,F
,F .
.(2)反应②的反应类型:消去反应.
(3)写出反应④的化学方程式:
 .
.(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为
 .
.
分析 根据苯酚的性质可知,与氢气发生加成反应生成A为 ,
, 在浓硫酸作用下发生消去反应生成B为
在浓硫酸作用下发生消去反应生成B为 ,进而与溴发生加成反应生成C为
,进而与溴发生加成反应生成C为 ,C在NaOH乙醇溶液的作用下发生消去反应生成D为
,C在NaOH乙醇溶液的作用下发生消去反应生成D为 ,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由
,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由 可知应为1,4加成产物,则E为
可知应为1,4加成产物,则E为 ,F为
,F为 ,F最后水解可生成
,F最后水解可生成 ,结合有机物的结构和性质解答该题.
,结合有机物的结构和性质解答该题.
解答 解:根据苯酚的性质可知,与氢气发生加成反应生成A为 ,
, 在浓硫酸作用下发生消去反应生成B为
在浓硫酸作用下发生消去反应生成B为 ,进而与溴发生加成反应生成C为
,进而与溴发生加成反应生成C为 ,C在NaOH乙醇溶液的作用下发生消去反应生成D为
,C在NaOH乙醇溶液的作用下发生消去反应生成D为 ,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由
,D与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,由 可知应为1,4加成产物,则E为
可知应为1,4加成产物,则E为 ,F为
,F为 ,F最后水解可生成
,F最后水解可生成 ,
,
(1)根据分析可知B的结构简式为 ,F的结构简式为
,F的结构简式为 ,
,
故答案为: ;
; ;
;
(2)反应②为 在浓硫酸作用下发生消去反应生成
在浓硫酸作用下发生消去反应生成 ,该反应为消去反应,
,该反应为消去反应,
故答案为:消去反应;
(3)反应④为 在NaOH乙醇溶液的作用下发生消去反应生成
在NaOH乙醇溶液的作用下发生消去反应生成 ,反应的化学方程式为:
,反应的化学方程式为: ,
,
故答案为: ;
;
(3)D为 ,与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,则对应的副产品为:
,与溴可发生1,2加成或1,4加成,或全部发生加成反应生成四溴产物,则对应的副产品为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度中等,解答本题的关键是根据苯酚能发生加成反应的性质进行推断,注意掌握常见有机物结构与性质,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 在钠、钾、铷三种单质中,钠的熔点最高 | |
| B. | 所有碱金属均为银白色 | |
| C. | 同一主族卤素单质从上到下熔沸点依次升高 | |
| D. | 液溴易挥发,可以通过水封的方式进行保存 |
4.下列分子中的14个碳原子一定会处于同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.
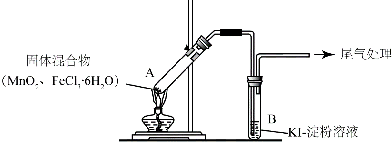
实验操作和现象:
(1)现象i 中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
方案1B中溶液变为蓝色
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
5.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 正、逆反应速率都为零 |
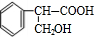 ;E中所含官能团的名称为醛基、羧基.
;E中所含官能团的名称为醛基、羧基.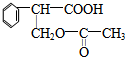 +H2O.
+H2O.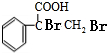 .
.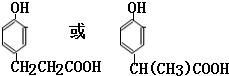 .(写出一种即可)
.(写出一种即可)