题目内容
(1)原电池是把 转化为 的装置;电子 的电极为负极,发生 反应;电子 的电极为正极,发生 反应.
(2)电解池是把 转化为 的装置;和电源 相连的电极为阳极,发生 反应;和电源 相连的电极为阴极,发生 反应.
(2)电解池是把
考点:原电池和电解池的工作原理
专题:
分析:(1)根据原电池是利用自发的氧化还原反应将化学能转化为电能的装置,其中活泼的金属作负极,发生氧化反应,不活泼的作正极发生还原反应,电子从负极流向正极来判断;
(2)根据电解池是利用在电流的作用下将电能转化为化学能的装置,其中和电源正极相连的电极为阳极,发生氧化反应;
和电源负极相连的电极为阴极,发生还原反应来判断;
(2)根据电解池是利用在电流的作用下将电能转化为化学能的装置,其中和电源正极相连的电极为阳极,发生氧化反应;
和电源负极相连的电极为阴极,发生还原反应来判断;
解答:
解:(1)根据原电池是利用自发的氧化还原反应将化学能转化为电能的装置,其中活泼的金属作负极,发生氧化反应,不活泼的作正极发生还原反应,电子从负极流向正极,故答案为:化学能,电能,流出,氧化,流入,还原;
(2)根据电解池是利用在电流的作用下将电能转化为化学能的装置,其中和电源正极相连的电极为阳极,发生氧化反应;
和电源负极相连的电极为阴极,发生还原反应,故答案为:电能,化学能,正极,氧化,负极,还原;
(2)根据电解池是利用在电流的作用下将电能转化为化学能的装置,其中和电源正极相连的电极为阳极,发生氧化反应;
和电源负极相连的电极为阴极,发生还原反应,故答案为:电能,化学能,正极,氧化,负极,还原;
点评:本题考查了原电池、电解池的原理,为高频考点,侧重于学生的分析能力,注意把握电子流向、电极判断,反应类型判断,题目难度不大.

练习册系列答案
相关题目
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况.下列反应中属于这种情况的是( )
①过量的锌与18mol?L-1的硫酸反应
②过量的氢气与少量氮气在一定温度、压强和催化剂存在下充分反应
③加热条件下浓盐酸与过量的MnO2反应
④加热条件下过量铜与浓硫酸反应
⑤过量稀硫酸与块状石灰石反应.
①过量的锌与18mol?L-1的硫酸反应
②过量的氢气与少量氮气在一定温度、压强和催化剂存在下充分反应
③加热条件下浓盐酸与过量的MnO2反应
④加热条件下过量铜与浓硫酸反应
⑤过量稀硫酸与块状石灰石反应.
| A、②③④⑤ | B、②③④ |
| C、①③④ | D、①②③④⑤ |
下列说法正确的是( )
| A、13C和14C属于同一种元素,它们互为同位素 |
| B、1H和2H是不同的粒子,但它们的质子数相等 |
| C、14C 和14N的质量数相等,它们互为同位素 |
| D、6Li和7Li的电子数相等,但中子数不相等 |
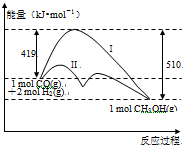 反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A、该反应的△H=+91 kJ/mol |
| B、加入催化剂,该反应的△H变小 |
| C、如果该反应生成液态CH3OH,则△H变大 |
| D、反应物的总能量大于生成物的总能量 |
烧碱的化学式为( )
| A、NaCl |
| B、NaOH |
| C、NaHCO3 |
| D、Na2CO3 |
钛是二十一世纪的“明星金属”.工业制钛以金红石为原料,发生的反应是:
反应Ⅰ:aTiO2+bCl2+cC
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
Ti+2MgCl2关于反应Ⅰ、Ⅱ的下列说法中正确的是( )
反应Ⅰ:aTiO2+bCl2+cC
| 1173K |
| 1220K~1420K |
| A、反应Ⅰ中的TiO2是氧化剂 |
| B、TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂 |
| C、a=b=c=2 |
| D、每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子 |