题目内容
2. 按要求完成下列小题.
按要求完成下列小题.(1)0.5molNH3的质量为8.5g,共有0.5NA个分子,5NA个电子.
(2)在标准状况下,224mL某气体的质量为0.64g,该气体的摩尔质量为64g/mol.
(3)配制100mL0.1mol/L的Na2CO3溶液,需要Na2CO3•10H2O的质量为2.86g 或2.9g.
(4)标准状况下,4.8g CH4气体的体积为6.72L,它与同状况下13.44L H2S气体含有相同数目的氢原子.
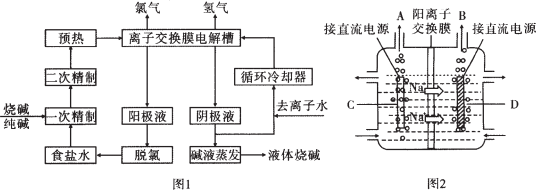
(5)如图是某化学实验室从化学试剂商店买回的盐酸试剂标签上的部分内容.
①该浓盐酸的物质的量浓度为11.9mol/L.
②用该浓盐酸与200mL1mol/L的NaOH溶液恰好反应所需该浓盐酸的体积是16.8mL.
分析 (1)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算解答,一个氨气分子含有10个电子;
(2)根据质量和体积之间的关系公式m=nM=$\frac{V}{{V}_{m}}$×M来计算;
(3)根据m=nM=cvM计算;
(4)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$结合分子构成计算;
(5)①根据c=$\frac{1000ρω}{M}$计算该盐酸的物质的量浓度;
②盐酸和氢氧化钠反应按1:1反应,据此计算需要浓盐酸的体积.
解答 解:(1)0.5molNH3的质量m=nM=0.5mol×17g/mol=8.5g;0.5molNH3分子含有氨气分子的个数N=nNA=0.5mol×NA=0.5NA,一个氨气分子含有10个电子,因此含有电子数为:10×0.5NA=5NA,
故答案为:8.5g;0.5NA;5NA;
(2)根据质量和体积之间的关系公式m=nM=$\frac{V}{{V}_{m}}$×M可得出,M=$\frac{m{V}_{m}}{V}$=$\frac{0.64g×22.4L/mol}{0.224L}$=64g/mol
故答案为:64g/mol;
(3)实验室配制100mL 0.100mol•L-1 Na2CO3溶液需要Na2CO3•10H2O的质量为:0.1L×0.1mol/L×286g/mol=2.9g,
故答案为:2.9g;
(4)n(CH4)=$\frac{4.8g}{16g/mol}$=0.3mol,
V(CH4)=0.3mol×22.4L/mol=6.72L,
n(H)=0.3mol×4=1.2mol,
则n(H2S)=$\frac{1}{2}$n(H)=0.6mol.
V(H2S)=0.6mol×22.4L/mol=13.44L,
故答案为:6.72;13.44;
(5)①根据c=$\frac{1000ρω}{M}$可知,该盐酸的物质的量浓度为C=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L
故答案为:11.9mol/L;
②HCl+NaOH=NaCl+H2O,盐酸和氢氧化钠反应按1:1反应,所以需要浓盐酸的体积为$\frac{200mL×1mol/L}{11.9mol/L}$=16.8mL,
故答案为:16.8.
点评 本题综合考查物质的量的计算,侧重于学生计算能力的考查,为高考常见题型,注意把握相关计算公式的运用,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 盐酸 | B. | 碳酸氢铵 | C. | 二氧化硫 | D. | 氯气 |
| A. | 塑料 | B. | 油脂 | C. | 淀粉 | D. | 橡胶 |
| A. | 用滤纸称量氢氧化钠固体 | |
| B. | 将溶解的氢氧化钠溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容后倒转容量瓶几次摇匀溶液,发现凹液面最低点低于刻度线,再补几滴水到刻度线 |
| A. | 无色透明的酸性溶液:MnO4-、K+、Cl-、SO42- | |
| B. | 0.1 mol/LNaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| D. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、CO32- |
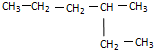 与
与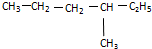 ⑨CS2
⑨CS2 .
.