题目内容
13.下列物质的水溶液能够导电,但属于非电解质的是( )| A. | 盐酸 | B. | 碳酸氢铵 | C. | 二氧化硫 | D. | 氯气 |
分析 能够导电的溶液中存在自由移动的带电荷离子,在水溶液和熔融状态下都不导电的化合物为非电解质,注意单质和混合物既不是电解质,也不是非电解质,据此进行解答.
解答 解:A.盐酸为混合物,不属于电解质和非电解质,故A错误;
B.碳酸氢铵为电解质,不属于非电解质,故B错误;
C.二氧化硫在水溶液中能够导电,由于导电离子不是二氧化硫电离的,则二氧化硫为非电解质,故C正确;
D.氯气为单质,单质既不是电解质,也不是非电解质,故D错误;
故选C.
点评 本题考查了电解质与非电解质、溶液导电性判断,题目难度不大,明确电解质与非电解质的概念为解答关键,注意掌握溶液导电性条件,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.某小组同学按图所示流程进行实验,用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,请你参与讨论并回答相关问题.
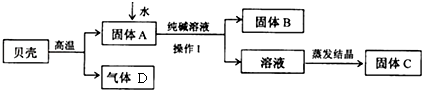
(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
【反思与评价】根据实验流程,可以判定甲同学设计的方案不严密,理由是:因为碳酸钠、氢氧化钙的水溶液都显碱性,无论碳酸钠过量还是氢氧化钙过量,混有碳酸钠或氢氧化钙的氢氧化钠配成溶液后,都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(2)固体A和还原铁粉是食品包装袋中常用的两种干燥剂.
①可区分两种干燥剂的简单物理方法是用磁铁吸引;
②操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使液体受热均匀,防止液滴外溅;
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH;乙:NaOH和Na2CO3的混合物;丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.他们的实验操作、现象和结论记录如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀硫酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 | 猜想成立 |
1.下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法.正确的一组为( )
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | CCl4 | Br2 | 用NaOH溶液洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
18.下列物质中,没有固定沸点的是( )
| A. | 正已烷 | B. | 苯 | C. | 汽油 | D. | 乙烯 |
5.100mL 2.0mol/L的盐酸中Cl-的物质的量为( )
| A. | 2.0mol | B. | 0.20mol | C. | 1.0mol | D. | 0.10mol |
3.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2?2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
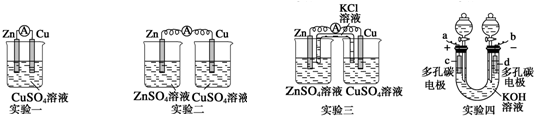
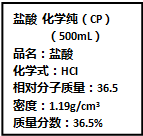 按要求完成下列小题.
按要求完成下列小题.