题目内容
化学实验装置的科学设计是实验是否取得预期效果的关键.请回答下列有关实验装置的相关问题:
Ⅰ.图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为图B装置进行酯化反应效果比A要好,他的理由是 ;某同学乙经查阅资料认为图C装置进行酯化反应效果更好,他的理由是

Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)碳与浓硝酸反应的方程式 .甲同学的实验应该在 中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是 (用化学方程式表示),所以他认为应该检验 (填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.

(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号) .
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸.
③先加热木炭,再加入冷浓硝酸; ④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用 (结合方程式与文字表述).
(5)C装置中出现的现象是 ,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式 .
Ⅰ.图A为“人教版”教材制备乙酸乙酯的实验装置,某同学甲认为图B装置进行酯化反应效果比A要好,他的理由是

Ⅱ.某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)碳与浓硝酸反应的方程式
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,所以他认为甲同学观点是错误的,他的理由是

(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸.
③先加热木炭,再加入冷浓硝酸; ④先加热浓硝酸,然后将木炭投入其中;
(4)请用平衡移动原理解释B装置的作用
(5)C装置中出现的现象是
考点:性质实验方案的设计,实验装置综合
专题:
分析:I.图B装置进行酯化反应效果比A要好,与冷凝管的作用有关;图C装置进行酯化反应效果更好,与冷凝与分离产物使平衡正向移动有关;
Ⅱ.(1)(1)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,二氧化氮有毒;
(2)浓硝酸不稳定,加热易分解;要检验该反应发生则要检验二氧化碳;
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解;
(4)温度低,平衡向生成四氧化二氮的方向移动;
(5)二氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应.
Ⅱ.(1)(1)碳与浓硝酸反应生成二氧化碳、二氧化氮和水,二氧化氮有毒;
(2)浓硝酸不稳定,加热易分解;要检验该反应发生则要检验二氧化碳;
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解;
(4)温度低,平衡向生成四氧化二氮的方向移动;
(5)二氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应.
解答:
解:Ⅰ.图B装置进行酯化反应效果比A要好,是因B中冷凝管便于冷凝回流,减少反应物损失;图C装置进行酯化反应效果更好,是因装置C中既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成,
故答案为:便于冷凝回流,减少反应物损失;既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成;
Ⅱ.(1)碳与浓硝酸反应的方程式为C+4HNO3 (浓)
4NO2↑+CO2↑+2H2O,二氧化氮有毒,则甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求,
故答案为:C+4HNO3 (浓)
4NO2↑+CO2↑+2H2O;通风橱;
(2)浓硝酸不稳定,加热易分解生成二氧化氮,浓硝酸和碳在加热条件下反应也生成二氧化氮,所以对实验造成干扰,反应方程式为4HNO3
4NO2↑+O2↑+2H2O,所以要想检验浓硝酸和碳反应不能根据是否生成二氧化氮判断,要根据CO2判断,故答案为:4HNO3
4NO2↑+O2↑+2H2O;CO2;
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解,但浓硝酸和碳的反应必须在加热条件下才能发生,所以要先将炭加热,再将碳投入冷的浓硝酸中,故答案为:②;
(4)根据题给信息知,0℃时四氧化二氮为液体,所以温度越低,二氧化氮越向四氧化二氮方向移动,所以要使用冰水混合物冷却二氧化氮气体,从而将混合气体中的二氧化氮除去,防止二氧化碳的检验,故答案为:常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2;
(5)氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,所以看到的现象是:C中溶液变浑浊,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应,所以溶液呈出现硝酸根离子,反应方程式为4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O,离子反应为4NO2+O2+4OH-=4NO3-+2H2O,
故答案为:C中溶液变浑浊(或产生白色沉淀);4NO2+O2+4OH-=4NO3-+2H2O.
故答案为:便于冷凝回流,减少反应物损失;既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成;
Ⅱ.(1)碳与浓硝酸反应的方程式为C+4HNO3 (浓)
| ||
故答案为:C+4HNO3 (浓)
| ||
(2)浓硝酸不稳定,加热易分解生成二氧化氮,浓硝酸和碳在加热条件下反应也生成二氧化氮,所以对实验造成干扰,反应方程式为4HNO3
| ||
| ||
(3)浓硝酸不稳定,加热易分解,为防止干扰,应该防止浓硝酸分解,但浓硝酸和碳的反应必须在加热条件下才能发生,所以要先将炭加热,再将碳投入冷的浓硝酸中,故答案为:②;
(4)根据题给信息知,0℃时四氧化二氮为液体,所以温度越低,二氧化氮越向四氧化二氮方向移动,所以要使用冰水混合物冷却二氧化氮气体,从而将混合气体中的二氧化氮除去,防止二氧化碳的检验,故答案为:常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2;
(5)氧化碳能和氢氧化钡溶液反应生成难溶性的碳酸钡,所以看到的现象是:C中溶液变浑浊,二氧化氮、氧气和水反应生成硝酸,硝酸和氢氧化钡发生酸碱中和反应,所以溶液呈出现硝酸根离子,反应方程式为4NO2+O2+2Ba(OH)2=2Ba(NO3)2+2H2O,离子反应为4NO2+O2+4OH-=4NO3-+2H2O,
故答案为:C中溶液变浑浊(或产生白色沉淀);4NO2+O2+4OH-=4NO3-+2H2O.
点评:本题考查性质实验方案的设计,为高频考点,把握图中装置的作用、反应原理及实验技能为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

练习册系列答案
相关题目
 某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )
某有机物与H2按1:1的物质的量之比加成后生成的产物结构为:则该有机物可能的结构有(羟基与碳碳双键相连的结构不稳定,不考虑其存在)( )| A、4种 | B、5种 | C、6种 | D、7种 |
下列有实验装置的说法,正确的是( )
A、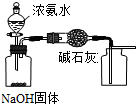 用装置制取干燥纯净的NH3 |
B、 用装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置可证明非金属性Cl>C>Si |
D、 装置向左推动针筒活塞可检验该装置的气密性 |
化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A、家中发生天然气泄漏,不能在室内用电话报警 |
| B、洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
| C、双氧水可用于杀菌、消毒、漂白 |
| D、明矾既可用于净水,又可杀菌消毒 |
某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( )


| A、能和碳酸钠溶液反应的官能团有2种 |
| B、1mol该有机物最多能与2molH2发生加成 |
C、与 互为同分异构体 互为同分异构体 |
| D、既可以发生取代反应又可以发生氧化反应 |
水的电离平衡曲线如图所示,下列说法中,正确的是( )


| A、图中A、B、D三点处Kw的大小关系:B>A>D |
| B、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3?H2O)的值逐渐减小 |
| C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 |
| D、A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、S042- |

