题目内容
16.下列离子方程式正确的是( )| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 金属钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| C. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | |
| D. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O |
分析 A.醋酸为弱酸,应保留化学式;
B.二者反应生成氢氧化钾和氢气;
C.不符合反应客观事实;
D.二者反应生成碳酸钠和水.
解答 解:A.碳酸钙与醋酸反应的离子反应为:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑,故A错误;
B.金属钾与水反应,离子方程式:2K+2H2O═2K++2OH-+H2↑,故B正确;
C.硝酸具有强的氧化性,铁与稀硝酸反应生成氮的氧化物,得不到氢气,故C错误;
D.小苏打与氢氧化钠溶液混合,离子方程式:HCO3-+OH-=CO2↑+H2O,故D正确;
故选:BD.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应为解答的关键,注意离子反应遵循客观事实,注意硝酸的强氧化性,题目难度不大.

练习册系列答案
相关题目
11.下列有关Ca(ClO)2溶液的叙述不正确的是( )
| A. | 该溶液中Na+、K+、NO${\;}_{3}^{-}$、Cl-可大量共存 | |
| B. | 向溶液中通入CO2气体可以增强溶液漂白性 | |
| C. | 和浓盐酸反应的离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O | |
| D. | 通入过量SO2气体反应的离子方程式:SO2+ClO-+Ca2++H2O=CaSO4↓+Cl-+2H+ |
7.NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 1molCu和足量热浓硫酸反应可生成22.4LSO2气体 | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.2mol氧气转移的电子数为0.2NA | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
11.下列关于元素周期表的结构叙述正确的是( )
| A. | 第n(n>1)周期共含有(8-n)种非金属元素 | |
| B. | 同一周期,第ⅡA族与第ⅢA族元素原子序数的差值可以为1、10或25 | |
| C. | 第ⅠA族习惯上又称为碱金属元素 | |
| D. | 有七个主族,七个副族,一个第Ⅷ族,一个零族,共16个纵行 |
1.下列操作正确的是( )
| A. | 锥形瓶在装待测液前要用待测液润洗2~3次 | |
| B. | 用25mL酸式滴定管量取20.00mLKMnO4溶液 | |
| C. | 测某溶液pH:用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测 | |
| D. | 加热蒸发NaHCO3溶液得纯净的NaHCO3 |
8.下列实验装置图完全正确的是( )
| A. | 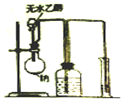 测量钠与乙醇反应生成H2的体积 | B. |  制取乙烯 | ||
| C. | 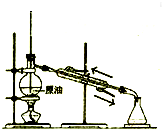 蒸馏石油 | D. | 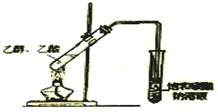 制取乙酸乙酯 |
6.下列有关晶胞的叙述,正确的是( )
| A. | 晶胞是晶体的最小的结构重复单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都属于该晶胞 | |
| D. | 已知晶胞的组成不能推知晶体的组成 |
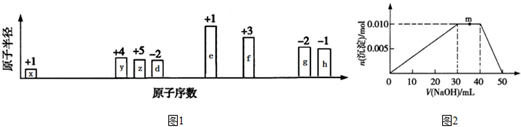
 (或
(或
 等);
等);