题目内容
15.分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( )①Fe2O3、CaO、Al2O3都是碱性氧化物
②根据反应中是否有氧气参加,将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据纯净物中是否含氧元素,来判断是否属于氧化物
⑤根据分散系的稳定性将分散系分为胶体、溶液和浊液.
| A. | 只有①②④ | B. | 只有③⑤ | C. | 只有④ | D. | 都不对 |
分析 ①碱性氧化物是和酸反应生成盐和水的氧化物,氧化铝是两性氧化物;
②依据化学反应中元素化合价变化实质是电子转移,将化学反应分为氧化还原反应和非氧化还原反应;
③元素最外层电子数多少不能作为金属非金属的分类依据;
④氧化物中必须含有氧,且只能是两种元素;
⑤依据分散系的分散质微粒直径分类.
解答 解:①依据碱性氧化物概念分析,Fe2O3、CaO都是碱性氧化物,Al2O3是两性氧化物,故①错误;
②氧化还原反应的特征是元素化合价变化,实质是电子转移,可以依据是否有电子转移把反应分为氧化还原反应和非氧化还原反应,故②错误;
③最外层电子数少的可能是非金属,比如氢,所以元素原子最外层电子数的多少不能作为分类的依据,故③错误;
④氧化物中必须含有氧,且只能是两种元素,故④错误;
⑤分散系分为胶体、溶液和浊液的依据是分散质的微粒直径大小进行分类,故⑤错误;
故选D.
点评 本题考查了化学概念的理解和分析判断,氧化还原反应的实质,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 同周期的IA族元素的金属性比IIA族的元素金属性强 | |
| B. | 第三周期元素的阴离子半径从左到右逐渐减小 | |
| C. | VIA族的气态氢化物一定比VA族的稳定性强 | |
| D. | 原子晶体的熔点一定比离子晶体的高 |
6.在标准状况下 ①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3下列对这四种气体的质量关系从大到小表达正确的是( )
| A. | ③>②>①>④ | B. | ②>③>④>① | C. | ②>③>①>④ | D. | ①>③>④>② |
3.对于某些离子的检验及结论一定正确的是( )
| A. | 加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中一定不含有K+ |
10.下列有关铁及其化合物的说法不正确的是( )
| A. | 铁是一种银白色金属 | |
| B. | 铁在常温下与水不反应,但可在高温条件下与水蒸气反应生成Fe3O4和H2 | |
| C. | 常温下,铁与浓HNO3、浓H2SO4均不反应 | |
| D. | 铁在氯气中燃烧生成FeCl3,其溶于水形成的溶液呈棕黄色 |
20.下列叙述正确的是( )
| A. | 酸、碱、盐之间发生的反应一定属于复分解反应 | |
| B. | AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大 | |
| C. | 根据分散系是否具有丁达尔现象可将分散系分为溶液、胶体和浊液 | |
| D. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 |
7.在容积不变的密闭容器中,一定条件下发生反应:2A?B(g)+2C(g),且达到平衡.当升高温度时气体的密度增大,则下列叙述中正确的是( )
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 物质A一定为非气态,且正反应是吸热反应 | |
| D. | 若向容器中充入稀有气体,则平衡向右移动 |
10.下列物质中,能够导电的电解质是( )
| A. | 氨水 | B. | 蔗糖 | C. | 铜导线 | D. | 熔融的KCl |
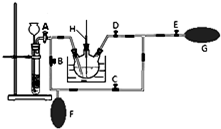 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.