题目内容
12.下列离子方程式书写正确的是( )| A. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
分析 A.二氧化硫少量,离子方程式按照二氧化硫的组成书写;
B.HCl优先与氢氧根离子反应,剩余的氢氧根离子与镁离子反应生成氢氧化镁沉淀;
C.生成的是络合物硫氰化铁,不是沉淀;
D.漏掉了铵根离子与氢氧根离子生成一水合氨的反应.
解答 解:A.少量SO2通入NaClO溶液中,二者发生氧化还原反应,反应的离子方程式为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO,故A正确;
B.等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合,HCl优先反应,正确的离子方程式为:Mg2++2H++4OH-═Mg(OH)2↓+2H2O,故B错误;
C.用硫氰化钾溶液可以检验溶液中的Fe3+,硫氰化钾是络合物不是沉淀,正确的离子方程式为:Fe3++3SCN-?Fe(SCN)3,故C错误;
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2,铵根离子也参与反应,正确的离子方程式为:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
2.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如下:
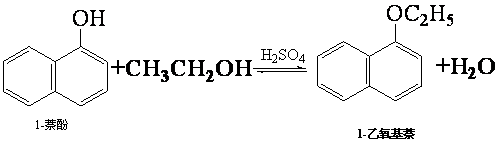
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合.将混合液置于如图1所示的容器中加热充分反应.实验中使用过量乙醇的原因是提高1-萘酚的转化率.
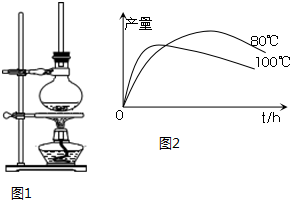
(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图2所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化;温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.
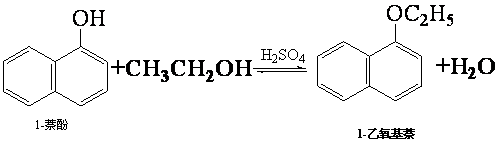
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |

(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图2所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化;温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.
3.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 已知在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol.若将含0.5mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2 O2(g)═CO2(g)+2H2O (g)△H=-890.3kJ•mol-1 |
7.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 两个羟基 | B. | 一个醛基 | C. | 两个醛基 | D. | 一个羟基 |
17.生活中处处有化学,下列说法正确的是( )
| A. | 制饭勺、高压锅等的不锈钢是纯铁 | B. | 铝制品可以长期用作餐具 | ||
| C. | Al(OH)3可用于制胃酸中和剂 | D. | 医用酒精浓度是95% |
4.科学家人工合成的第一种有机物是( )
| A. | 酒精 | B. | 纤维素 | C. | 尿素 | D. | 橡胶 |
1.下列关于甲烷的叙述不正确的是( )
| A. | 甲烷分子是以碳原子为中心的正四面体结构 | |
| B. | 甲烷不能使溴水或高锰酸钾溶液褪色 | |
| C. | 甲烷在空气中加热到1000℃,分解成炭黑和氢气 | |
| D. | 甲烷在氧气中燃烧生成二氧化碳和水的实验事实说明甲烷中含有碳元素和氢元素 |
2.下列反应的离子方程式书写正确的是( )
| A. | 用FeCl3溶液腐蚀含铜印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 将氯气溶氢氧化钠溶液:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 将磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+═2Fe3++Fe2++4H2O |