题目内容
13.下列配制溶液的操作能引起浓度偏高的是( )| A. | 用1g 98%的浓硫酸加入4g水配制1:4硫酸溶液 | |
| B. | 配制2.0mo1•L-1硫酸溶液时,最后在容量瓶中加水稀释到标线,塞好盖子倒转摇匀后,发现液面低于标线 | |
| C. | 在100mL无水乙醇中,加人2g甲醛配制2%的甲醛洒精溶液 | |
| D. | 在80mL水中,加入18.4mol•L-1浓硫酸20mL,配制3.68mol•L-1稀硫酸 |
分析 A.硫酸溶液中,浓度越大其密度越大,根据质量和密度之间的关系确定其体积关系;
B.根据c=$\frac{n}{V}$来分析误差,如果n偏大或V偏小都导致配制溶液浓度偏高;
C.由于乙醇的密度为0.78g/mL,则所得溶液的质量小于100g;
D.硫酸溶液中,浓度越大其密度越大,根据c=$\frac{n}{V}$来分析溶液浓度.
解答 解:A.浓硫酸的密度大于1g/mL,水的密度是1g/mL,用1g98%的浓硫酸加4g水配成1:4(体积比)的硫酸,浓硫酸的体积和水的体积比小于1:4,导致配制溶液体积比偏小,故A错误;
B.配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线,溶质的物质的量和溶液的体积都不变,所以配制溶液浓度不变,故B错误;
C.由于乙醇的密度为0.78g/mL,故在100mL无水乙醇中加入2g甲醛,所得溶液的质量小于100g,则溶液的质量分数大于2%,故C正确;
D.浓硫酸溶液密度大于水的密度,在80mL水中加入18.4mol/L的硫酸20mL,溶液体积小于100mL,所以配制浓度高于3.68mol/L,故D正确;
故选CD.
点评 本题考查了化学实验方案的评价,侧重考查溶液配制方法及误差分析,题目难度中等,明确溶液配制方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
3.在一定条件下,下列药物的主要成分都能发生四种反应的是( )
①取代反应 ②加成反应③水解反应 ④中和.
①取代反应 ②加成反应③水解反应 ④中和.
| A. | 维生素B5: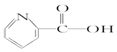 | B. | 阿司匹林: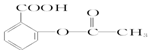 | ||
| C. | 芬必得: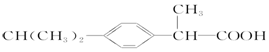 | D. | 摇头丸: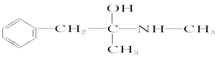 |
1.下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是( )
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中.
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
8.在温度t1和t2下(t2>t1),卤素单质X2(g)和H2反应生成HX的平衡常数如下表:
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,得到的结论是( )
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
2.1-乙氧基萘常用作香料,也可合成其他香料.实验室制备1-乙氧基萘的过程如下:
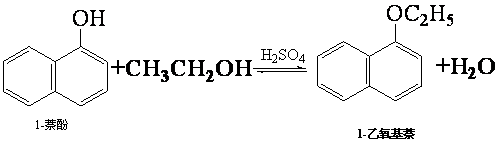
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
(1)将72g 1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合.将混合液置于如图1所示的容器中加热充分反应.实验中使用过量乙醇的原因是提高1-萘酚的转化率.
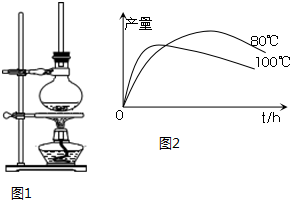
(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图2所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化;温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.
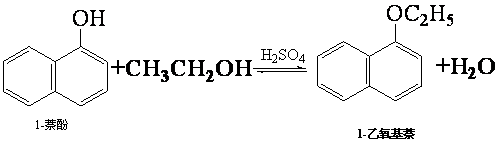
已知:1-萘酚的性质与苯酚相似,有难闻的苯酚气味.相关物质的物理常数:
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |

(2)装置中长玻璃管的作用是:冷凝回流.
(3)该反应能否用实验室制备乙酸乙酯的装置不能(选填“能”或“不能”),简述理由产物沸点大大高于反应物乙醇,会降低产率.
(4)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层.为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤.正确的顺序是a(选填编号).
a.③②④①b.①②③④c.②①③④
(5)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图2所示,时间延长、温度升高,1-乙氧基萘的产量下降可能的两个原因是1-萘酚被氧化;温度高乙醇大量挥发或温度高发生副反应.
(6)提纯的产品经测定为43g,本实验中1-乙氧基萘的产率为50%.
6.下列说法中,正确的是( )
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
7.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中不可能有( )
| A. | 两个羟基 | B. | 一个醛基 | C. | 两个醛基 | D. | 一个羟基 |
