题目内容
某学生NaHCO3和KHCO3组成的混合物与等物质的量浓度的50mL盐酸反应进行试验,产生CO2 体积(V)与混合物质量(m)的关系如下表:
(1)写出NaHCO3与盐酸反应的离子方程式 .
(2)所用盐酸的物质的量浓度为 .
(3)混合物中NaHCO3的质量分数为 (保留小数点后一位).
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| M(混合物) | 9.2g | 15.7g | 27.6g |
| V(标准状况) | 2.24L | 3.36L | 3.36L |
(2)所用盐酸的物质的量浓度为
(3)混合物中NaHCO3的质量分数为
考点:有关混合物反应的计算
专题:计算题
分析:盐酸同量,混合物的质量增加,由于第②组实验所得气体多于第①组实验,说明加入混合物9.2 g时盐酸过量,第②组与第③组所得气体相等,说明第②组盐酸完全反应,生成3.36L二氧化碳需要混合物的质量为
×9.2g=13.8g<26.56,故第②组固体混合物有剩余,第②组实验中发生反应H++HCO3-═CO2↑+H2O,计算生成二氧化碳的物质的量,由方程式可知n(HCl)=n(CO2),根据c=
计算盐酸的物质的量浓度,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知n(CO2)=n(NaHCO3)+n(KHCO3),再利用混合物质量列方程计算x、y的值,进而计算混合物中NaHCO3的物质的量分数.
| 3.36 |
| 2.24 |
| c |
| V |
解答:
解:(1)NaHCO3与盐酸反应的离子方程式为H++HCO3-═CO2↑+H2O,故答案为:H++HCO3-═CO2↑+H2O;
(2)盐酸同量,混合物的质量增加,由于第②组实验所得气体多于第①组实验,说明加入混合物9.2 g时盐酸过量,第②组与第③组所得气体相等,说明第②组盐酸完全反应,生成3.36L二氧化碳需要混合物的质量为
×9.2g=13.8g<26.56,故第②组固体混合物有剩余,盐酸完全反应,由H++HCO3-═CO2↑+H2O可知,n(CO2)=
=0.15mol,n(HCl)=n(CO2)=0.15mol,盐酸的物质的量浓度为
=3mol/L,故答案为:3mol/L;
(3)第①组实验中混合物完全反应,盐酸过量,固体混合物完全反应,生成二氧化碳的物质的量为
=0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,则:
根据碳元素守恒可知:x+y=0.1mol,
混合物质量为9.2g,所以84x+100y=9.2g,
联立方程解得x=0.05 mol,y=0.05 mol,
混合物中NaHCO3的质量分数为
×100%=45.7%,故答案为:45.7%.
(2)盐酸同量,混合物的质量增加,由于第②组实验所得气体多于第①组实验,说明加入混合物9.2 g时盐酸过量,第②组与第③组所得气体相等,说明第②组盐酸完全反应,生成3.36L二氧化碳需要混合物的质量为
| 3.36 |
| 2.24 |
| 3.36L |
| 22.4L/mol |
| 0.15mol |
| 0.05L |
(3)第①组实验中混合物完全反应,盐酸过量,固体混合物完全反应,生成二氧化碳的物质的量为
| 2.24L |
| 22.4L/mol |
根据碳元素守恒可知:x+y=0.1mol,
混合物质量为9.2g,所以84x+100y=9.2g,
联立方程解得x=0.05 mol,y=0.05 mol,
混合物中NaHCO3的质量分数为
| 0.05×84 |
| 0.05×84+0.05×100 |
点评:本题考查混合物的计算,为高频考点,关键是比较三组数据,根据二氧化碳的体积变化与固体质量判断是否完全反应,题目难度中等,侧重学生对数据的分析处理能力、思维能力考查.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列反应中必须加入氧化剂才能进行的是( )
| A、Cl2→Cl- |
| B、Zn→Zn2+ |
| C、KClO3→KCl |
| D、CuO→CuCl2 |
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的
(同温同压下),此时N2、O2、CO2的物质的量之比为( )
| 8 |
| 9 |
| A、1:1:0 |
| B、6:9:0 |
| C、3:4:1 |
| D、3:3:2 |
下列说法不正确的是( )
| A、SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同 |
| B、水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合 |
| C、放热反应 的反应速率,不一定比吸热反应的反应速快 |
| D、同温同压下,3mol C2H4(g)和1mol CO(g)的密度相等 |
下列关于工业生产过程的叙述错误的是( )
| A、联合制碱法生产的两种产品一种是碱,一种是盐 |
| B、在硫酸工业生产过程的接触室中运用热交换技术可充分利用能源 |
| C、在合成氨生产中有原料循环使用的工艺,可以提高原料的利用率 |
| D、用烧碱溶液吸收精制硝酸产生的尾气中的氮氧化物符合绿色化学理念 |
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定含有Na+ |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
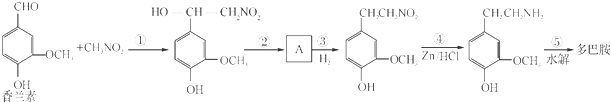
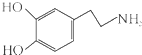 多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质.这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐.多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下: