题目内容
下列关于工业生产过程的叙述错误的是( )
| A、联合制碱法生产的两种产品一种是碱,一种是盐 |
| B、在硫酸工业生产过程的接触室中运用热交换技术可充分利用能源 |
| C、在合成氨生产中有原料循环使用的工艺,可以提高原料的利用率 |
| D、用烧碱溶液吸收精制硝酸产生的尾气中的氮氧化物符合绿色化学理念 |
考点:纯碱工业(侯氏制碱法),工业制取硫酸,工业合成氨
专题:化学应用
分析:A.依据联合制碱法的原理和产物解答;
B.使用热交换装置可节约能源;
C.原料循环使用,能够减少成本,提高原料的利用率;
D.烧碱溶液能与NO2和NO反应.
B.使用热交换装置可节约能源;
C.原料循环使用,能够减少成本,提高原料的利用率;
D.烧碱溶液能与NO2和NO反应.
解答:
解:A.联合制碱法的原理:①NH3+CO2+H2O═NH4HCO3 ②NH4HCO3+NaCl=NaHCO3↓+NH4Cl ③2NaHCO3
Na2CO3+H2O+CO2↑,得到的产物为碳酸钠和氯化铵,都是盐,故A错误;
B.二氧化硫被氧化为三氧化硫是放热反应,使用热交换装置热量,充分利用可节约能源,故B正确;
C.氢气与氮气反应生成氨气为可逆反应,不能完全转化,循环使用氮气和氢气,可以减少成本,提高原料的利用率,故C正确;
D.二氧化氮、一氧化氮有毒,能够与氢氧化钠发生反应:2NaOH+NO+NO2=2NaNO2 +H2O,所以工业上用氢氧化钠吸收精制硝酸产生的尾气,故D正确;
故选:A.
| ||
B.二氧化硫被氧化为三氧化硫是放热反应,使用热交换装置热量,充分利用可节约能源,故B正确;
C.氢气与氮气反应生成氨气为可逆反应,不能完全转化,循环使用氮气和氢气,可以减少成本,提高原料的利用率,故C正确;
D.二氧化氮、一氧化氮有毒,能够与氢氧化钠发生反应:2NaOH+NO+NO2=2NaNO2 +H2O,所以工业上用氢氧化钠吸收精制硝酸产生的尾气,故D正确;
故选:A.
点评:本题考查了常见工业流程及评价,明确工业生产过程和原理、熟悉物质的性质是解题关键,题目难度中等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
将铁片放入下列溶液中,能发生氧化还原反应但不是置换反应的溶液是( )
| A、稀H2SO4 |
| B、CuSO4 |
| C、NaNO3 |
| D、FeCl3 |
一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增加14g,则原混合气体中CO和O2的物质的量之比是( )
| A、4:9 | B、1:1 |
| C、7:6 | D、4:3 |
下列实验操作中,主要不是从安全因素考虑的是( )
| A、用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 |
| B、给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热 |
| C、给试管里的液体加热时,试管口应略向上倾斜(约45°角),外壁干燥后再预热 |
| D、酒精灯在不使用时,必须盖上灯帽 |
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图.关于A的下列说法中,正确的是( )
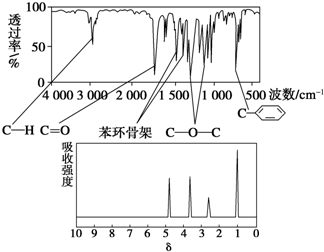

| A、与A属于同类化合物的同分异构体只有2种 |
| B、A在一定条件下可与4 mol H2发生加成反应 |
| C、A分子属于酯类化合物,在一定条件下不能发生水解反应 |
| D、符合题中A分子结构特征的有机物只有1种 |


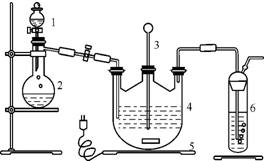 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S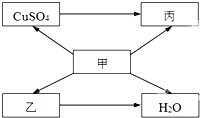 甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).
甲、乙、丙为初中化学常见物质,其中乙为胃液中的一种酸.他们相互转化关系如图所示(“→”表示物质变化,部分反应条件和部分生成物已省略).