题目内容
9.已知15g A物质和10.5g B物质恰好完全反应生成7.2g C、1.8g D和0.3mol E,则物质E的摩尔质量是( )| A. | 55 mol•g-1 | B. | 55 mol | C. | 55 g•mol-1 | D. | 55g |
分析 根据质量守恒定律计算生成的E物质的质量,再利用M=$\frac{m}{n}$计算E的摩尔质量.
解答 解:15gA物质和10.5gB物质完全反应,生成7.2gC物质,1.8gD物质和0.3molE物质,
由质量守恒定律可知,E的质量为15g+10.5g-7.2g-1.8g=16.5g,
E的物质的量为0.3mol,则E的摩尔质量为$\frac{16.5g}{0.3mol}$=55g/mol,
故选C.
点评 本题考查化学方程式计算、摩尔质量的计算,关键数据根据质量守恒定律计算E的质量,熟练掌握物质的量有关计算,注意摩尔质量的单位,比较基础.

练习册系列答案
相关题目
19.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
4.用惰性电极进行电解,下列说法正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,消耗完氯化铜后电解就会停止 |
14.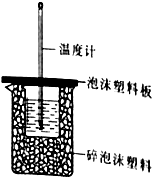 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
1.除去CO2中混有的少量SO2气体,最好选用的试剂是( )
| A. | 澄清石灰水 | B. | 品红溶液 | C. | NaOH溶液 | D. | 饱和NaHCO3溶液 |
18.下列物质不能直接由单质经化合反应得到的是( )
| A. | FeCl3 | B. | Mg3N2 | C. | SO3 | D. | Cu2S |
 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.