题目内容
1.下列离子方程式中,正确的是( )| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2 Fe2+ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.电荷数不守恒;
B.一水合氨为弱电解质,应保留化学式;
C.电荷不守恒;
D.二者反应生成氯化铁;
解答 解:A.钠和冷水反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.AlCl3溶液中加入足量的氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B错误;
C.三氯化铁溶液中加入铁粉,离子方程式:2Fe3++Fe═3Fe2+,故C错误;
D.FeCl2溶液跟Cl2反应,离子方程式:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循原子个数守恒、电荷数守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | BaO2量不变 | C. | 氧气压强不变 | D. | BaO量不变 |
12.某有机物A的分子式为C4HxCly,其中x+y=10,已知该有机物有9种同分异构体(不考虑立体异构),则X可能为:①2,②3,③8,④10.下列组合正确的是( )
| A. | ①③ | B. | ①② | C. | ②③ | D. | ②④ |
9.如图所表示的反应是吸热反应的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
10.向1L 1mol/L AlCl3溶液中滴加一定量的NaOH溶液,若产生沉淀为0.8mol,则消耗的NaOH的物质的量可能是( )
| A. | 0.8 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.8 mol |
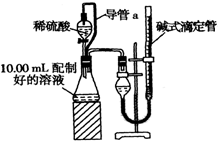 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.