题目内容
7.摩尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
用30%的NaOH溶液和废铁屑(含少量油污、铁锈等)混合、煮沸,以除去铁屑表面油污,然后冷却、洗涤、分离,将分离出的NaOH溶液装入③中,废铁屑放入②中.
(1)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞B、C(填字母).向容器①中通人氢气的目的是赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+.待锥形瓶中的铁屑快反应完时,关闭活塞BC(或B或C),打开活塞A.②中继续产生的氢气会将②(填①、②或③,后同)容器中的溶液压入①容器,在常温下放置一段时间,混合溶液底部将结晶析出硫酸亚铁铵.
为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.称取4.0克的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液的体积为10.00ml.
(2)试配平反应的离子方程式:
1 MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)本实验的指示剂D.A.酚酞 B.甲基橙 C.石蕊 D.不需要
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗导致滴定结果(填“偏小”、“偏大”或“无影响”)偏大.
(5)观察装KMnO4滴定管读数时,若滴定前仰视,滴定后俯视则结果会导致测得的Fe2+溶液浓度测定值偏小(选填“偏大”“偏小”或“无影响”)
(6)产品中Fe2+质量分数为14%.
分析 (1)由装置图可知,容器②的长导管插入液面以下,氢气只能从容器②的短导管出来,经过容器③加向容器①中.通入氢气排尽装置内空气,防止Fe2+氧化,待空气排尽后,要将反应生成的硫酸亚铁溶液压入饱和硫酸铵溶液中,生成摩尔盐;
(2)依据氧化还原反应电子守恒、电荷收、原子守恒配平写出离子方程式:
(3)滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点;
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗,会使被稀释,导致测量出的标准液的体积会偏大,据此分析;
(5)滴定管读数时,若滴定前仰视,滴定后俯视,则读出来的数据比实际用去的体积要小,据此分析;
(6)根据关系式5Fe2+~MnO4-计算4.0g产品中Fe2+的物质的量,再换算成质量,利用质量分数定义计算.
解答 解:(1)由装置图可知,向容器①中通入氢气,应关闭活塞A,打开活塞B、C.硫酸铵溶液中的溶解O2,容器①液面上部有O2,Fe2+易被氧化为Fe3+,通入氢气赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+,待空气排尽后,要将反应生成的硫酸亚铁溶液压入饱和硫酸铵溶液中,所以待锥形瓶中的铁屑快反应完时,关闭活塞BC(或B或C),打开活塞A,②中继续产生的氢气会将②容器中的溶液压入 ①容器,
故答案为:A;B、C;赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2,防止Fe2+被氧化为Fe3+;BC(或B或C);A;②;①;
(2)高锰酸钾与Fe2+的反应是MnO4-~Mn2+~5e-;Fe2+~Fe3+~e-;依据电子守恒,铁离子和亚铁离子前乘5,依据原子守恒和电荷守恒得到反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:1 5 8H+ 1 5 4H2O;
(3)滴定终点利用高锰酸钾溶液呈紫红色做指示剂指示到终点,故选D;
(4)装KMnO4滴定管用蒸馏水润洗后,未用KMnO4液润洗,会使被稀释,导致测量出的标准液的体积会偏大,所以导致测得的Fe2+溶液浓度偏大,
故答案为:偏大;
(5)滴定管读数时,若滴定前仰视,滴定后俯视,则读出来的数据比实际用去的体积要小,所以导致测得的Fe2+溶液浓度偏小,
故答案为:偏小;
(6)假设4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.2000mol/L
所以x=$\frac{0.01L×0.2000mol/L×5}{1}$=0.01mol.
所以产品中Fe2+质量分数为$\frac{0.01×56}{4.0}$×100%=14%,
故答案为:14%.
点评 本题以莫尔盐的制备为载体,考察物质分离提纯等有关实验操作、实验原理与装置的理解分析与评价、对催化能力的探究实验的理解、氧化还原反应滴定应用以计算、以及在新情境下综合运用知识解决问题的能力等.题目有一定的难度.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,容易忽略所取溶液体积,为易错点.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案| A. | Na+的电子排布图: | |
| B. | HF的电子式: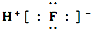 | |
| C. | Fe2+的核外电子排布式:1s22s22p63s23p63d6 | |
| D. | N2的结构简式::N≡N: |
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中有两元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式
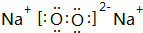 .
. | 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)比较①与⑤的最高价氧化物对应的水化物,酸性强的是H2CO3(填化学式);能通过说明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(写反应的化学方程式).
(3)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因3NO2+H2O=2HNO3+NO(用化学方程式表示)
(5)比较③与⑥的氢化物,更稳定H2O(填化学式)
(6)③④两元素组成的化合物A2B2型电子式为:
 ,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
,存在的化学键是离子键、共价键,写出A2B2与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.(7)⑨的单质与水反应所得离子化合物中阳离子半径<S2-(填“>”或“<”).
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
| A. | 煤燃烧时将化学能全部转化为热能 | |
| B. | 原电池将化学能转化为电能 | |
| C. | 二次电池充电时将电能转化为化学能 | |
| D. | 镁条燃烧时将部分化学能转化为光能 |
 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.