题目内容
Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族.
(1)Q的最高价氧化物,其固体属于 晶体,比较Q、X、Y 第一电离能由大到小的顺序 .
(2)R的氢化物属于 分子(填“极性”或“非极性”).
(3)X的常见氢化物的VSEPR模型是 ;
(4)已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3.则绿色晶体配合物的化学式为 .
(1)Q的最高价氧化物,其固体属于
(2)R的氢化物属于
(3)X的常见氢化物的VSEPR模型是
(4)已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3.则绿色晶体配合物的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Y22+、Q的低价氧化物都与X单质分子均为等电子体,则Q的低价氧化物都与X单质分子均为双原子分子,且核外电子数相同,可知Q为C元素,对应的氧化物为CO,X为N元素,单质N2与CO为等电子体,且电子总数为14,可知Y为O元素,R与Q同族,应为第ⅣA族元素,以此解答(1)(2)(3);
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子.
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
解答:
解:Y22+、Q的低价氧化物都与X单质分子均为等电子体,则Q的低价氧化物都与X单质分子均为双原子分子,且核外电子数相同,可知Q为C元素,对应的氧化物为CO,X为N元素,单质N2与CO为等电子体,且电子总数为14,可知Y为O元素,R与Q同族,应为第ⅣA族元素,
(1)Q的最高价氧化物为CO2,固体为分子晶体,
同周期元素从左到右第一电离能逐渐减小,N原子最外层为半充满结构,第一电离能大于O,则第一电离能由大到小的顺序是N>O>C,
故答案为:分子;N>O>C;
(2)R与Q同族,应为第ⅣA族元素,对应的氢化物具有甲烷的结构特点,为非极性分子,故答案为:非极性;
(3)X为N元素,常见氢化物为氨气,形成3个σ键,孤电子对数为
=1,可价层电子对为4,VSEPR模型是四面体,故答案为:四面体;
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2?H2O,
故答案为:[TiCl(H2O)5]Cl2?H2O.
(1)Q的最高价氧化物为CO2,固体为分子晶体,
同周期元素从左到右第一电离能逐渐减小,N原子最外层为半充满结构,第一电离能大于O,则第一电离能由大到小的顺序是N>O>C,
故答案为:分子;N>O>C;
(2)R与Q同族,应为第ⅣA族元素,对应的氢化物具有甲烷的结构特点,为非极性分子,故答案为:非极性;
(3)X为N元素,常见氢化物为氨气,形成3个σ键,孤电子对数为
| 5-3×1 |
| 2 |
(4)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2?H2O.
点评:本题考查了物质结构和性质,为高频考点,侧重于学生的分析能力的考查,涉及电子排布式的书写、原子杂化类型的判断、空间构型的判断等知识点,难度中等,难点是配位数的判断,注意配合物中内外界的划分.

练习册系列答案
相关题目
下列属于纯净物的是( )
| A、液氨 | B、浓氨水 |
| C、纯盐酸 | D、65%的硝酸 |
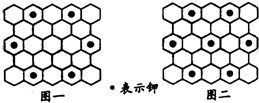 北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )| A、题干中所举出的6种钾石墨,属于同素异形体 | ||
| B、若某钾石墨的原于分布如图一所示,则它所表示的是C24K | ||
| C、若某钾石墨的原子分布如图二所示,则它所表示的是C12K | ||
D、另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4
|
下列有关电负性的说法中正确的是( )
| A、主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B、在元素周期表中,元素电负性从左到右越来越小 |
| C、金属元素的电负性一定小于非金属元素的电负性 |
| D、在形成化合物时,电负性越小的元素越容易显正价 |