题目内容
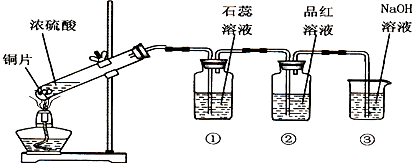
如图是产生并验证SO2某些性质的装置图.试回答:
(1)写出浓硫酸与铜反应的化学方程式 .
(2)装置①中出现的现象是 ,说明SO2的水溶液显 性.
(3)装置②中出现的现象是 ,说明SO2具有 性质.
(4)装置③的作用是 ,反应的离子方程式为 .
(1)写出浓硫酸与铜反应的化学方程式
(2)装置①中出现的现象是
(3)装置②中出现的现象是
(4)装置③的作用是

考点:性质实验方案的设计
专题:实验设计题
分析:实验室制SO2并验证SO2某些性质,浓硫酸与铜在加热条件下反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,
(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)二氧化硫能与水反应生成亚硫酸,亚硫酸使石蕊试液变红,体现了酸性氧化物的性质;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,写出二氧化硫与氢氧根离子反应的离子方程式.
(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)二氧化硫能与水反应生成亚硫酸,亚硫酸使石蕊试液变红,体现了酸性氧化物的性质;
(3)二氧化硫具有漂白性,能使品红溶液褪色;
(4)为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,写出二氧化硫与氢氧根离子反应的离子方程式.
解答:
解:实验室制SO2并验证SO2某些性质,浓硫酸与铜在加热条件下反应生成二氧化硫,①中二氧化硫与水反应生成亚硫酸,遇石蕊变红;②中品红溶液褪色;③为尾气处理装置,二氧化硫与NaOH反应可防止二氧化硫排放在环境中,
(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为:溶液变成红色,说明二氧化硫的水溶液为酸性,
故答案为:溶液变成红色;酸;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,故答案为:溶液褪色;漂白;
(4)③中盛放的是氢氧化钠溶液,其作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH-═SO32-+H2O,
故答案为:吸收二氧化硫,防止污染环境;SO2+2OH-═SO32-+H2O.
(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(2)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象为:溶液变成红色,说明二氧化硫的水溶液为酸性,
故答案为:溶液变成红色;酸;
(3)因二氧化硫具有漂白性,则②中的品红溶液褪色,故答案为:溶液褪色;漂白;
(4)③中盛放的是氢氧化钠溶液,其作用是吸收二氧化硫,防止二氧化硫污染环境,发生的离子反应为:SO2+2OH-═SO32-+H2O,
故答案为:吸收二氧化硫,防止污染环境;SO2+2OH-═SO32-+H2O.
点评:本题综合考查二氧化硫的制备以及性质探究实验,全面考查学生的实验能力和元素化合物知识的综合理解和运用,有利于培养学生的分析能力和实验能力,难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
如图中a、b、c、d、e为周期表前四周期的一部分元素,下列叙述正确的是( )
| a | ||||
| b | ||||
| c | d | |||
| e |
| A、b元素除0价外,只有一种化合价 |
| B、五种元素中,c元素的性质最稳定 |
| C、b和d的气态氢化物分别溶于水,溶液的酸性:b>d |
| D、e元素最高价氧化物对应的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
下列各组元素都属于p区的是( )
| A、原子序数为1,6,7的元素 |
| B、O,S,P |
| C、Fe,Cu,Cl |
| D、Na,Li,Mg |
某元素基态原子的最外层电子排布为ns1,当它跟卤素结合时可形成的化学键( )
| A、一定是共价键 |
| B、一定是离子键 |
| C、可能是共价键,也可能是离子键 |
| D、一定是极性共价键 |
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

| A、装置中出口①处的物质是氯气,出口②处的物质是氢气 | ||
| B、该离子交换膜只能让阳离子通过,不能让阴离子通过 | ||
C、装置中发生反应的离子方程式为:2Cl-+2H+
| ||
| D、该装置是将电能转化为化学能 |

