题目内容
3.铜及其化合物在工业上有许多用途.以硅孔雀石(主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还有少量SiO2、Fe2O3和FeCO3等)为原料制备CuCl2的工艺流程如图所示: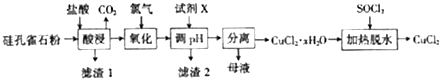
回答下列问题:
(1)CuCO3•Cu(OH)2与盐酸反应的化学方程式为CuCO3•Cu(OH)2+4HCl=2CuCl2+CO2↑+3H2O
(2)为提高“酸浸”时钢元素的浸出率,可采取的措施是ABCD(填字母).
A.适当提高反应温度 B.适当提高盐酸浓度
C.适当加快搅拌速率 D.适当延长酸浸时间
(3)“氧化”时发生反应的离子方程式为Cl2+2Fe 2+=2Fe 3++2Cl-.“氧化”时也可以用H2O2代替氯气,H2O2的电子式为
 .
.(4)“滤渣1”、“滤渣2”的成为分别是SiO2、H2SiO3、Fe(OH)3(写化学式).
(5)为了不影响产品的质量,试剂X可以是CuCO3或CuO或Cu(OH)2(写化学式).“调pH”时,pH不能过高,其原因是PH过高,铜离子水解生成 氢氧化铜沉淀,导致产品的产率降低.
(6)已知:SOCl2H2O$\stackrel{△}{?}$SO2↑+2HCl.“加热脱水”时,加入SOCl2的目的是抑制氯化铜水解.
分析 由制备实验流程可知,硅孔雀石(主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还有少量SiO2、Fe2O3和FeCO3等)用酸浸,Cu2(OH)2CO3、CuSiO3•2H2O、Fe2O3和FeCO3等均与盐酸反应,只有SiO2不反应,则滤渣1为SiO2、H2SiO3,过滤得滤液中含有铁离子、亚铁离子、铜离子,通入氯气将亚铁离子氧化成铁离子,高节PH值,使溶液中铁离子生成Fe(OH)3沉淀,为了不引入新杂质,可以用CuCO3、CuO、Cu(OH)2等调节PH值,所以X为CuCO3或CuO或Cu(OH)2,过滤得滤渣2为Fe(OH)3,滤液为氯化铜溶液,将滤液蒸发浓缩、冷却结晶可得氯化铜晶体,SOCl2与水作用可生成氯化氢可以抑制氯化铜水解,所以将氯化铜晶体在加入SOCl2的条件下加热脱水可得氯化铜固体,以此来解答.
解答 解:由制备实验流程可知,硅孔雀石(主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还有少量SiO2、Fe2O3和FeCO3等)用酸浸,Cu2(OH)2CO3、CuSiO3•2H2O、Fe2O3和FeCO3等均与盐酸反应,只有SiO2不反应,则滤渣1为SiO2、H2SiO3,过滤得滤液中含有铁离子、亚铁离子、铜离子,通入氯气将亚铁离子氧化成铁离子,高节PH值,使溶液中铁离子生成Fe(OH)3沉淀,为了不引入新杂质,可以用CuCO3、CuO、Cu(OH)2等调节PH值,所以X为CuCO3或CuO或Cu(OH)2,过滤得滤渣2为Fe(OH)3,滤液为氯化铜溶液,将滤液蒸发浓缩、冷却结晶可得氯化铜晶体,SOCl2与水作用可生成氯化氢可以抑制氯化铜水解,所以将氯化铜晶体在加入SOCl2的条件下加热脱水可得氯化铜固体,
(1)CuCO3•Cu(OH)2与盐酸生成 氯化铜、二氧化碳和水,反应的化学方程式为CuCO3•Cu(OH)2+4HCl=2CuCl2+CO2↑+3H2O,
故答案为:CuCO3•Cu(OH)2+4HCl=2CuCl2+CO2↑+3H2O;
(2)为提高“酸浸”时铜元素的浸出率,可采取适当提高反应温度、适当提高盐酸浓度、适当加快搅拌速率、适当延长酸浸时间等措施,故选ABCD;
(3)“氧化”时是用氯气氧化亚铁离子,发生反应的离子方程式为 Cl2+2Fe 2+=2Fe 3++2Cl-,“氧化”时也可以用H2O2代替氯气,H2O2的电子式为 ,
,
故答案为:Cl2+2Fe 2+=2Fe 3++2Cl-; ;
;
(4)根据上面的分析可知,“滤渣1”的成分是SiO2、H2SiO3,“滤渣2”的成分是 Fe(OH)3,
故答案为:SiO2、H2SiO3;Fe(OH)3;
(5)根据上面的分析可知,试剂X可以是CuCO3或CuO或Cu(OH)2,“调pH”时,pH不能过高,其原因是PH过高,铜离子水解生成 氢氧化铜沉淀,导致产品的产率降低,
故答案为:CuCO3或CuO或Cu(OH)2;PH过高,铜离子水解生成 氢氧化铜沉淀,导致产品的产率降低;
(6)SOCl2与水作用可生成氯化氢可以抑制氯化铜水解,所以“加热脱水”时,加入SOCl2的目的是抑制氯化铜水解,
故答案为:抑制氯化铜水解.
点评 本题借助硅孔雀石为原料制取氯化铜的工艺流程,考查了铜及其化合物性质分析判断、化学方程式的书写、盐类水解的应用等,掌握基础是关键,题目难度中等.


| A. | ①装置中阴极处产生的气体能够使湿润的淀粉KI试纸变蓝 | |
| B. | ②装置不能完成在铁制品上镀铜 | |
| C. | ③装置中电子由b极流向a极 | |
| D. | ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
向下图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液退色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是
A | B | C | D | NO2 | HCl | SO2[来 | |
Y | Na2SO3溶液 | 水 | Na2SO3溶液 | 饱和NaHCO3溶液 |
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |
| A. | 蛋白质 | B. | 花生油 | C. | 柠檬黄 | D. | 纤维素 |
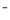 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )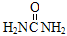
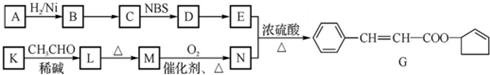
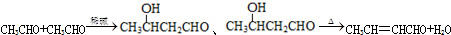
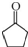
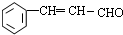 +2Cu(OH)2 $\stackrel{△}{→}$
+2Cu(OH)2 $\stackrel{△}{→}$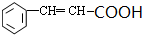 +Cu2O↓+3H2O.
+Cu2O↓+3H2O. 2,3-二甲基戊烷
2,3-二甲基戊烷