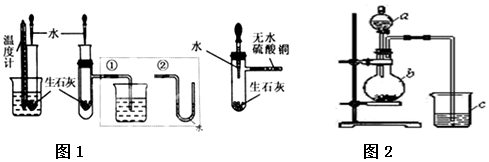
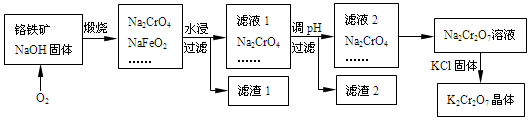
题目内容
2.亚磷酸(H3PO3)是重要的无机精细化工品,熔点74℃,沸点180℃,易溶于水、乙酸等.(1)H3PO3 是一种二元弱酸,在水中的电离方程式为H3PO3?H2PO3-+H+,H2PO3-?HPO32-+H+.
(2)H3PO3 在200℃时开始分解生成两种产物,分别是PH3和H3PO4(填化学式).
(3)某厂利用工业废渣亚磷酸钙(CaHPO3,难溶于水)制取H3PO3 的工艺流程如图:
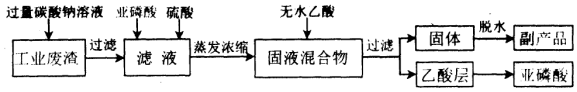
①工业废渣与Na2CO3溶液反应的离子方程式为CaHPO3+CO32-=CaCO3+HPO32-.
②向滤液中先加入H3PO3调节pH 为5,此时溶液中c(H2PO3-):c(HPO32-)=40:1;
再加入H2SO4,主要反应离子方程式为H++H2PO3-=H3PO3.(已知:H3PO3 的 Ka1=5.0×10-2,Ka2=2.5×10-7)
③从乙酸层中分离出H3PO3,采用的方法是d(选填序号).
a.过滤 b.分液 c.蒸发 d.减压蒸馏
④副产品的主要成分为Na2SO4(填化学式).
分析 (1)亚磷酸(H3PO3) 为二元弱酸,分步电离且电离可逆;
(2)根据氧化还原反应中元素化合价有升有降分析;
(3)利用工业废渣亚磷酸钙(CaHPO3,难溶于水)制取H3PO3 的工艺流程:向工业废渣中加入过量碳酸钠溶液,发生反应:CaHPO3+CO32-=CaCO3+HPO32-,过滤,向含有HPO32-的滤液中亚磷酸和硫酸,H++H2PO3-=H3PO3,向得到的固液混合物中加入无水乙酸,亚磷酸溶于乙酸,过滤,对乙酸层减压蒸馏得产品,副产品的主要成分为硫酸钠,据此分析.
解答 解:(1)亚磷酸(H3PO3) 为二元弱酸,分步电离且电离可逆,电离方程式为H3PO3?H2PO3-+H+,H2PO3-?HPO32-+H+;
故答案为:H3PO3?H2PO3-+H+,H2PO3-?HPO32-+H+;
(2)H3PO3中P为+3价,分解生成的PH3中P为-3价,则另一种分解产物中P的化合价应该升高,为+5价,该物质为:H3PO4;
故答案为:H3PO4;
(3)①工业废渣亚磷酸钙(CaHPO3)与过量碳酸钠溶液生成碳酸钙和亚磷酸氢钠,离子方程式为:CaHPO3+CO32-=CaCO3+HPO32-;
故答案为:CaHPO3+CO32-=CaCO3+HPO32-;
②pH 为5,即c(H+)=10-5mol/L,H3PO3 是一种二元弱酸,电离方程式为H3PO3?H2PO3-+H+,Ka1=5.0×10-2,第一步电离程度较大,则c(H2PO3-)=c(H+)=10-5mol/L,H2PO3-?HPO32-+H+,Ka2=2.5×10-7,第二步电离程度极小,Ka2=$\frac{c({H}^{+})•c(HP{{O}_{3}}^{2-})}{c({H}_{2}P{{O}_{3}}^{-})}$≈c(HPO32-)=2.5×10-7,c(H2PO3-):c(HPO32-)=10-5:2.5×10-7=40:1;加入H2SO4,反应离子方程式为H++H2PO3-=H3PO3;
故答案为:40:1;H++H2PO3-=H3PO3;
③亚磷酸与乙酸沸点相差较大,用减压蒸馏的方式从乙酸层中分离出H3PO3;
故答案为:d;
④该流程中的钠离子与硫酸根离子未除去,副产品的主要成分为Na2SO4;
故答案为:Na2SO4.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、电离平衡常数计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与数据处理能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | HNO2 | CH2=CH2 | NaOH | Fe |
| b | NO | CH3CH2Br | NaHCO3 | FeCl3 |
| c | NO2 | CH3CH2OH | Na2CO3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
| A. | 上述稀释过程中,H2A分子及所有离子浓度均减小 | |
| B. | 上述稀释过程中,$\frac{{c(HA}^{-})}{{c(H}_{2}A)}$的变化趋势保持增大 | |
| C. | 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-) | |
| D. | 根据H2A的电离常数,可推知0.1mol•L-1NaHA溶液的pH值大于7 |
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | 分子式为C5H12O的醇类有5种结构 | |
| C. | 乙醇发生氧化反应生成乙酸,乙酸和乙醇发生取代反应生成乙酸乙酯 | |
| D. | 有机物甲的分子式为C3H6,则甲与乙烯(C2H4)互为同系物 |
| A. | 葡萄糖变为葡萄糖酸 | B. | 植物油变成硬化油 | ||
| C. | 蛋白质变为氨基酸 | D. | 油脂变质(酸败) |
 的命名正确的是( )
的命名正确的是( )| A. | 2-甲基-3-乙基己烷 | B. | 2-甲基-3-丙基戊烷 | ||
| C. | 3-异丙基己烷 | D. | 4-甲基-3-丙基戊烷 |