��Ŀ����
17����Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⣮ij�о�С���������̿���Ҫ�ɷ�ΪMnO2������������������ͭ�Ƚ�����������������ͨ�����¼����̣����ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ������ʡ�ԣ���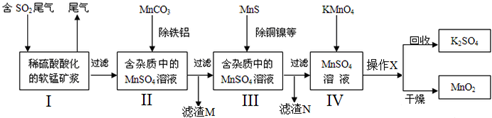
��ش��������⣺
��1��������������ʵ����ac��ѡ���ţ���
a����������ۺ����� b����ɫ��Ⱦ�ļ��� c������ļ��� d��������ն��ļ���
��2������I������ˮMnSO4�Ļ�ѧ����ʽ��MnO2+SO2=MnSO4��
����IV������ˮMnO2�Ļ�ѧ����ʽ��2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4��
��3������I�У���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+����ԭ����������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�����������������������M�ijɷ���Al��OH��3��Fe��OH��3��ͭԪ����CuS��ʽ����������N�У���д��ѧʽ��
��4����ƷMnO2�����������ݲ��ϣ��ö��Ե缫���MnSO4��Һ�����Ƶ�MnO2����MnO2���������ɣ�����缫���ƣ�
��5�������ѳ���SO2ֻ�����̿���MnO2��Ӧ������ͼʾ���̣���2.0 m3����״������SO2���������Ϊ60%��β��ͨ�����SO2���ѳ���Ϊ89.6%�����յõ�MnO2������10.44kg�����ڳ�ȥ��������ͭ���������ʵĹ����У����������Ԫ��Ϊ1.32kg��
���� ������������������̷�Ӧ���������̣���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+��MnS��ͭ�������ӻ�ԭΪ���ʣ�����������������̷�Ӧ���ɶ������̣�ͨ�����˻�ö������̣�
��1��SO2���γ����꣬�������ʵ���˷�������ۺ����ã�ͬʱҲ�����������γɣ�
��2������I������ˮMnSO4�ķ�ӦΪ�������̺Ͷ�����������Ӧ���ɣ�����IV������ˮMnO2�ķ�Ӧ�Ǹ��������ˮ��Һ������������Ϊ�������̣�
��3����������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ��Ƕȷ������������������������������Ϊ��������������������ͭ���ӻ�����������ɸ����ܵ���ͭ��
��4��������������ʧ���ӷ���������Ӧ��
��5��SO2+MnO2=MnSO4�����ݷ���ʽ���Ԫ���غ���⣮
��� �⣺������������������̷�Ӧ���������̣���MnCO3�ܳ�ȥ��Һ��Al3+��Fe3+��MnS��ͭ�������ӻ�ԭΪ���ʣ�����������������̷�Ӧ���ɶ������̣�ͨ�����˻�ö������̣�
��1����ɫ��Ⱦ��Ҫ�����ϵ��ѽ���������γɵģ�SO2���γ����꣬�������ʵ���˷�������ۺ����ã�ͬʱҲ�����������γɣ�����ac��ȷ��
�ʴ�Ϊ��ac��
��2������I������ˮMnSO4�ķ�ӦΪ�������̺Ͷ�����������Ӧ���ɣ���Ӧ�Ļ�ѧ����ʽΪ��MnO2+SO2=MnSO4������IV������ˮMnO2�ķ�Ӧ�Ǹ��������ˮ��Һ������������Ϊ�������̣���Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4��
�ʴ�Ϊ��MnO2+SO2=MnSO4��2KMnO4+3MnSO4+2H2O=K2SO4+5MnO2+2H2SO4��
��3����3������̼������������Һ�е��ᣬ������Һ�����ԣ��Ӷ��ٽ�Al3+��Fe3+ˮ���������������������������Ϊ��������������������ͭ���ӻ�����������ɸ����ܵ���ͭ��
�ʴ�Ϊ��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������Al��OH��3��Fe��OH��3��CuS��
��4��������������ʧ���ӣ�Mn2++2H2O-2e-=MnO2+4H+����MnO2�����������ɣ��ʴ�Ϊ��������
��5����Ӧ�Ķ�����������ʵ���Ϊ $\frac{2.0��1000}{22.4}$��60%��89.6%=48mol��
����SO2+MnO2=MnSO4��֪���������̵����ʵ���Ϊ48mol���������ɵĶ�������Ϊ10.44kg�������������̵����ʵ���Ϊx��
2KMnO4+3MnSO4+2H2O�T5MnO2+2H2SO4+K2SO4
3 87��5
x 10440g
x=72mol
��ȥ��������ͭ����������ʱ�����������Ԫ�أ�72mol-48mol��=24mol��
�൱��MnԪ�ص�����=24mol��55g/mol=1320g=1.32kg��
�ʴ�Ϊ��1.32��
���� ����ͨ���������̵��Ʊ������������ʵķ��롢�ᴿ���������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�Ʊ�ԭ��Ϊ���ؼ���ע�����ջ�ѧʵ������������������ʵķ��롢�ᴿ������������������ѧ���ķ�����������������ѧʵ��������

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�| A�� | ÿ����55 g K2Sת�Ƶ�����Ϊ6.02��1023 | |
| B�� | S��KNO3��Ϊ��ԭ�� | |
| C�� | ��Ӧ�����е�Ԫ�ر���ԭ | |
| D�� | CO2Ϊ��ԭ���� |

| A�� | ��Ӧ����ܼ��ܸ�����������ܼ��� | |
| B�� | ����a��ʹ���˴����������仯���� | |
| C�� | �Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H=-91kJ•mol-1 | |
| D�� | CO��g��+2H2��g��?CH3OH��1����g����H��-91kJ•mol-1 |
�ش��������⣺
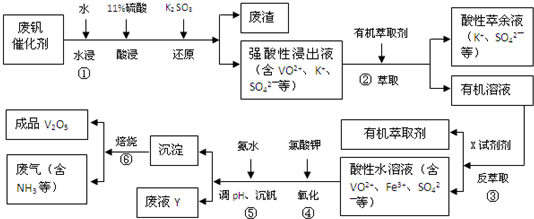
��1�����з�������Ҫ�ɷ���SiO2��
��2���ڡ����еı仯���̿ɼ�Ϊ����ʽ�е�R��ʾVO2+��Fe3+��HA��ʾ�л���ȡ������Ҫ�ɷ֣���
R2��SO4��n��ˮ�㣩+2n HA���л��㣩?2RAn���л��㣩+n H2SO4��ˮ�㣩��������ȡʱ��������������ԭ���Ǽ�����кͲ������ᣬƽ�����ƣ���߷�����ȡ�ʣ����з���ȡʱ�����X�Լ������ᣮ
��3����ɢ��з�Ӧ�����ӷ���ʽ��
1ClO3-+6VO2++6H+�T6VO3++1��Cl-��+3��H2O��
��4��25��ʱ��ȡ������ʵ��������õ��������ʺ���ҺpH֮��Ĺ�ϵ���±�
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
��5��д����ҺY�г�H+֮������������ӣ�Fe3+��VO3+��NH4+��K+����д���ּ��ɣ���
��6������ʱ�������е���������Һѭ�����ڢ��е�ˮ�������������չ����У�����ѭ�����õ����ʻ����л���ȡ������ˮ����������
��7��ȫ��Һ�������һ�����͵��ܴ����Чת��װ�ã���ͼ��ʾ��a��b��Ϊ���Ե缫������֪��V2+Ϊ��ɫ��V3+Ϊ��ɫ��VO2+Ϊ��ɫ��VO2+Ϊ��ɫ�������ʱ���Ҳ���Һ��ɫ����ɫ��Ϊ��ɫ����
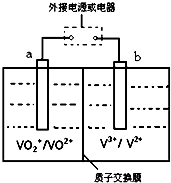
��ȫ��Һ����صĹ���ԭ��Ϊ��VO2++V2++2H+ $?_{������}^{������}$VO2++H2O+V3+�����ڿ�������������������䡱�����š�����ʱ��b����ֱ����Դ������
�ڷŵ�����У�a���ķ�ӦʽΪVO2++2H++e-=VO2++H2O����ת��1.0mol����ʱ����1.0mol H+���Ҳ�Ǩ�ƽ���ۣ�������ҡ�����

��֪������Ϣ��Cu����ϡ�����H2O2�Ļ��Һ��Ӧ��������ͭ����������ͭ������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe��OH��3 | Al��OH��3 | Cu��OH��2 |
| ��ʼ���� | 1.1 | 4.0 | 5.4 |
| ��ȫ���� | 3.2 | 5.2 | 6.7 |
��1��д��Cu��ϡ�����H2O2�Ļ��Һ��Ӧ�Ļ�ѧ����ʽ��Cu+H2O2+H2SO4=CuSO4+2H2O����
��2���ڲ���II�У�x��ȡֵ��Χ��[5.2��5.4����
��3���ڲ���III�У�����Ũ����Ҫ�IJ��������в��������ƾ��ơ��ձ���
��4��������a��ȡAl2��SO4��3.18H2O��̽��С����������ַ�����
�ף�����a$\stackrel{H_{2}SO_{4}}{��}$���Һ$\stackrel{������}{��}$Al2��SO4��3.18H2O
�ң�����a$\stackrel{H_{2}SO_{4}}{��}$���Һ$��_{����}^{����Al��}$����$\stackrel{������}{��}$Al2��SO4��3.18H2O
��������a$��_{����}^{NaOH��Һ}$��Һ$\stackrel{H_{2}SO_{4}}{��}$��ҺҺ$\stackrel{������}{��}$Al2��SO4��3.18H2O
�ۺϿ����������ַ�������߿����Ե����ң�����ţ���
��5��Ϊ�ⶨCuSO4.5H2O����Ĵ��ȣ���������ʵ�飺ȡa g �������100mL��Һ��ÿ��ȡ20.00mL�������������Ӻ���b mol��L-1EDTA��Na2H2Y������Һ�ζ����е�Cu2+�����ӷ���ʽΪCu2++H2Y2-=CuY2-+2H+�����ζ����յ㣬ƽ������EDTA��Һ12.00mL��CuSO4.5H2O����Ĵ�����$\frac{15b}{a}$��100%��
| A�� | NH4�ǰ����ķ���ʽ | B�� |  ��Cl-�Ľṹʾ��ͼ ��Cl-�Ľṹʾ��ͼ | ||
| C�� | C2H4����ϩ�Ľṹ��ʽ | D�� |  ���Ȼ��Ƶĵ���ʽ ���Ȼ��Ƶĵ���ʽ |

 ��д���䵥�ʵ�һ����Ҫ��;�����뵼����ϣ�������̫���ܵ�ذ�����������оƬ����
��д���䵥�ʵ�һ����Ҫ��;�����뵼����ϣ�������̫���ܵ�ذ�����������оƬ����
