题目内容
13.将锌投入到某稀盐酸溶液中,当生成0.2克氢气时,锌已完全反应,反应后的溶液体积为200毫升,求:(1)反应中消耗锌的质量.
(2)反应后得到的氯化锌溶液物质的量浓度.
分析 (1)依据Zn+2HCl=ZnCl2+H2↑,各物质的质量之比等于各分子的相对分子质量乘以化学计量数的积之比,进行计算;
(2)n(ZnCl2)=n(Zn)=$\frac{m(Zn)}{M(Zn)}$,带入c=$\frac{n}{V}$计算浓度.
解答 解:(1)设反应中消耗锌的质量为x,
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.2g
$\frac{65}{2}=\frac{x}{0.2g}$
x=6.5g,
答:反应中消耗锌的质量为6.5g;
(2)n(ZnCl2)=n(Zn)=$\frac{m(Zn)}{M(Zn)}$=$\frac{6.5g}{65g/mol}$=0.1mol,
c=$\frac{n}{V}$=$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:反应后得到的氯化锌溶液物质的量浓度为0.5mol/L.
点评 本题考查化学方程式的计算,难度不大,掌握物质的量为中心计算公式、化学方程式计算的步骤是解题的关键,注意计算题答题规范化的训练.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
11.下列各分子中,所有原子最外层都满足8电子稳定结构的是( )
| A. | XeF2 | B. | H2O | C. | CCl4 | D. | PCl5 |
4.下列有关实验的说法正确的是( )
| A. | 用湿润的pH试纸测稀盐酸的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液 | |
| C. | 用托盘天平称取5.85 gNaCl晶钵 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
18.用NA表示阿伏加德罗常数的值.下列叙述错误的是( )
| A. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L 已烷中含有共价键的数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中所含碳原子数为2NA | |
| D. | 足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA |
2.对于ⅣA族元素,下列叙述中不正确的是( )
| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |
3.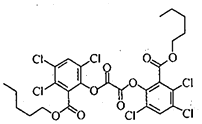 荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )
荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )
 荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )
荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光.该草酸二酯的结构简式如图所示.下列有关该草酸二酯的说法不正确的是( )| A. | 分子中含有一种含氧官能团 | |
| B. | 苯环上的一溴代物只有一种 | |
| C. | 可以发生取代反应和加成反应 | |
| D. | lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH |
 .
. .
.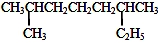 的系统命名是2,6-二甲基辛烷.
的系统命名是2,6-二甲基辛烷.
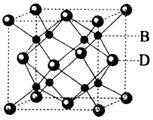 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答: