题目内容
写出下列物质在水溶液中电离的电离方程式
(1)NaHSO4:
(2)CH3COOH: .
(1)NaHSO4:
(2)CH3COOH:
考点:电离方程式的书写
专题:
分析:(1)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子;
(2)醋酸是弱电解质,在溶液中部分电离;
(2)醋酸是弱电解质,在溶液中部分电离;
解答:
解:(1)NaHSO4是强电解质,NaHSO4在水中电离出钠离子和硫酸根离子和氢离子,电离方程式为:NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-;
(2)醋酸是弱电解质,在溶液中部分电离,电离时电离出自由移动的氢离子和醋酸根离子,电离方程式为:CH3COOH≒CH3COO-+H+,
故答案为:CH3COOH≒CH3COO-+H+.
故答案为:NaHSO4═Na++H++SO42-;
(2)醋酸是弱电解质,在溶液中部分电离,电离时电离出自由移动的氢离子和醋酸根离子,电离方程式为:CH3COOH≒CH3COO-+H+,
故答案为:CH3COOH≒CH3COO-+H+.
点评:本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,题目难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- |
| C、一定温度下,1L0.5mol?L-1NH4Cl溶液中与2L0.25mol?L-1NH4Cl溶液含NH4+物质的量相同 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物总能量一定低于反应物总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、人类利用的能量都是通过化学反应获得的 |
| D、在化学反应中只有燃烧反应才能放出热量 |
下列溶液中的c(Cl-)与50mL1mol?L-1AlCl3溶液中的c(Cl-)相等的是( )
| A、150mL1mol?L-1氯化钠溶液 |
| B、75mL1mol?L-1氯化铁溶液 |
| C、150mL2mol?L-1氯化钾溶液 |
| D、75mL2mol?L-1氯化钙溶液 |
Cl2O与OF2互为等电子体,均能与水反应(与水解反应原理类似),Cl2O与水反应的化学方程式为:Cl2O+H2O=2HClO.下列说法正确的是( )
| A、Cl2O与水的反应属于氧化还原反应 |
| B、OF2、Cl2O分子的立体构型均为直线形 |
| C、Cl2O分子中的共用电子对偏向Cl,OF2分子中的共用电子对偏向F |
| D、OF2与水反应的化学方程式为:OF2+H2O=2HF+O2 |
下列表示对应化学反应的离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、硫酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2O |
| D、碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下列有关化学用语表示正确的是( )
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: | ||
C、氟化钠的电子式: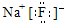 | ||
D、中子数为146、质子数为92 的铀原子
|
