题目内容
11.分别按下图中甲、乙所示装置进行实验,两个烧杯中的溶液均为100mL2.0mol•L-1的稀硫酸,乙中A为电流汁.
①下列叙述中,正确的是bd(填序号)
a.甲中锌片是负极,乙中铜片是正极
b.两烧杯中溶液pH均增大
c.两烧杯中铜片表面均有气泡产生
d.乙中SO42-向锌片移动
②装置乙工作时,导线中电子流向铜极(填“锌”或“铜”)
③把装置乙中的稀硫酸换成100mL2.0mol•L-1硫酸铜溶液,则铜极的电极反应式为Cu2++2e-=Cu,若实验中有0.2mol电子通过导线,溶液的质量将增加0.1g.
④如图所示能正确表示装置甲中反应过程能量变化的是a(填序号)

分析 锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题.
解答 解:①a.没有形成闭合回路,不能形成原电池,故错误;
b.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故正确;
c.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故错误;
d.乙能形成原电池反应,活泼金属锌为负极,铜为正极,阴离子移向负极,所以SO42-向锌片移动,故正确;
故答案为:bd;
②乙形成闭合回路,形成原电池,活泼金属锌为负极,铜为正极,导线中电子由负极流向正极铜,故答案为:铜;
③在乙实验中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu,负极锌反应为Zn-2e-=Zn2+,所以若实验中有0.2mol电子通过导线,溶液的质量将增加0.1×65-0.1×64=0.1g,故答案为:Cu2++2e-=Cu,0.1;
④甲没有形成闭合回路,不能形成原电池,只发生锌与硫酸反应生成硫酸锌和氢气,该反应为放热反应,则反应物总能量大于生成物总能量,所以能正确表示装置甲中反应过程能量变化的是a,故答案为:a.
点评 本题考查原电池的组成和工作原理,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
1.下列叙述不正确的是( )
| A. | 裂解和裂化均为化学变化 | |
| B. | 乙烯、苯分子中的所有原子都在同一平面上 | |
| C. | 裂化和裂解均是将相对分子质量大的烃断裂成相对分子质量小的烃的过程 | |
| D. | 实验室蒸馏石油的实验中,冷凝管的水流方向是上方进水下方出水 |
19.下列化合物中,既有离子键,又有共价键且是非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | KHSO4 | D. | NH4Cl |
6.下列说法正确的是( )
| A. | 离子键是阴、阳离子之间的相互吸引力 | |
| B. | 电能是一种使用最方便、污染最小的一次能源 | |
| C. | 由分子构成的物质中一定存在共价键 | |
| D. | 决定化学反应速率的主要因素是反应物体本身的性质 |
16.火箭所需要的巨大能量由特制的燃料来提供.有关燃料燃烧过程中的变化,下列说法不正确的是( )
| A. | 所有的燃烧过程均是放热的 | |
| B. | 需要点燃才能发生的燃烧过程是吸热的 | |
| C. | 所有燃料在燃烧过程中均会发生化学键的断裂 | |
| D. | 燃烧后产物的总能量一定小于反应物的总能量 |
20.下列离子方程式书写正确的是( )
| A. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ | |
| B. | 稀硫酸与氧化铜反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向沸水中滴加饱和氯化铁溶液制Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
1.下列变化中发生取代反应的是( )
| A. | 苯与溴水混合,水层褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 乙烷与氯气反应制氯乙烷 | |
| D. | 苯和氯气在一定条件下生成六氯环已烷 |

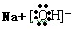 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键;