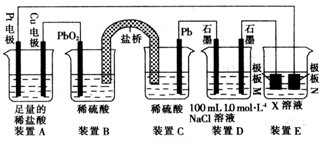
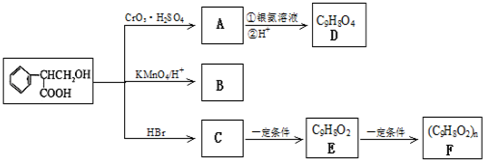
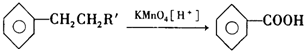题目内容
下列说法正确的是( )
| A、4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B、含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C、相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D、相同物质的量的OH-和CH3+含有相同数目的电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.4.2g丙烯的物质的量是0.1mol,1分子丙烯中含有9个共价键;
B.浓硫酸不会完全反应,转移电子数小于0.5mol;
C.相同条件,气体摩尔体积相等,CO和H2消耗氧气的体积比都是1:1;
D.OH-中含有10个电子,CH3+中含有8个电子.
B.浓硫酸不会完全反应,转移电子数小于0.5mol;
C.相同条件,气体摩尔体积相等,CO和H2消耗氧气的体积比都是1:1;
D.OH-中含有10个电子,CH3+中含有8个电子.
解答:
解:A.丙烯分子中含有9个共价键,4.2g丙烯物质的量是0.1mol,含有0.9mol共价键,数目为0.9×6.02×1023,故A错误;
B.随着反应的进行,浓硫酸浓度减小,变成稀硫酸后,不再与铜反应,故1mol浓硫酸与铜反应,被还原的物质的量小于0.5mol,电子总数小于6.02×1023,故B错误;
C.条件相同,气体摩尔体积相等,一氧化碳和氢气消耗氧气的体积比都是1:1,故1LCO和H2的混合气体完全燃烧消耗0.5LO2,故C正确;
D.氢氧根中含有10个电子,CH3+含有8个电子,故同物质的量的二者含有的电子数不同,故D错误;
故选C.
B.随着反应的进行,浓硫酸浓度减小,变成稀硫酸后,不再与铜反应,故1mol浓硫酸与铜反应,被还原的物质的量小于0.5mol,电子总数小于6.02×1023,故B错误;
C.条件相同,气体摩尔体积相等,一氧化碳和氢气消耗氧气的体积比都是1:1,故1LCO和H2的混合气体完全燃烧消耗0.5LO2,故C正确;
D.氢氧根中含有10个电子,CH3+含有8个电子,故同物质的量的二者含有的电子数不同,故D错误;
故选C.
点评:本题考查阿伏伽德罗常数的相关计算,浓硫酸的性质、电子数的计算等,难度不大.

练习册系列答案
相关题目
用铁片与稀硫酸反应制取氢气时,下列措施能使制取氢气生成速率加大的是( )
| A、降温 |
| B、不用稀硫酸,改用98%的浓硫酸 |
| C、不用稀硫酸,改用稀硝酸 |
| D、滴加少量CuSO4溶液 |
CaH2常作为生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是还原剂又是氧化剂 |
| D、既不是氧化剂又不是还原剂 |
质量相同的两种气体A、B,在同温同压下,A的密度大于B.下列说法错误的是( )
| A、相同条件下A占的体积比B大 |
| B、A的摩尔质量比B大 |
| C、A的分子数比B少 |
| D、A的物质的量比B小 |
在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+离子的浓度为0.1mol/L,Mg2+离子的浓度为0.25mol/L,Cl- 离子的浓度为0.2mol/L,则SO42-离子的物质的量的浓度为( )
| A、0.5 mol/L |
| B、0.45 mol/L |
| C、0.2 mol/L |
| D、0.25 mol/L |
能用H++OH-=H2O表示的是( )
| A、NaOH溶液和CO2的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、NaOH溶液和盐酸反应 |
| D、氨水和盐酸的反应 |