题目内容
X、Y、Z、W是元素周期表前四个周期中常见的元素,原子序数依次增大,其相关信息如下表:
请回答下列问题:
(1)Y、X两元素按原子数目比为1:2和1:3构成分子A和B,则A的结构式为 ;B的电子式为 .
(2)元素Y、Z形成的化合物的化学式为 ,该物质耐高温、强度高,是良好的耐热冲击材料,由此可推知它为 晶体.
(3)Z元素位于周期表中第 周期 族.一定量的Z单质在氢氧化钠溶液中反应时共转移了3mol电子,放出Q kJ热量,则该反应的热化学方程式为 .
(4)W2+电子排布式为 ,向试管里W元素+2价的氯化物的水溶液中通入氧气,发现溶液呈黄色,且试管内壁有红褐色固体生成,则该反应的离子方程式 .
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | +3价离子3d能级为半充满 |
(1)Y、X两元素按原子数目比为1:2和1:3构成分子A和B,则A的结构式为
(2)元素Y、Z形成的化合物的化学式为
(3)Z元素位于周期表中第
(4)W2+电子排布式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四个周期中常见的元素,原子序数依次增大,由X形成的单质是最清洁的能源,则X为H元素;Y原子最外层有3个未成对电子,次外层只有一对成对电子,Y原子只能有2个电子层,核外电子排布为1s22s22p3,则Y为N元素;Z存在质量数为27,中子数为14的核素,则Z原子质子数=27-14=13,故Z为Al元素;W元素+3价离子3d能级为半充满,离子的核外电子排布为1s22s22p63s23p63d5,故W原子核外电子数=23+3=26,则W为Fe元素,据此解答.
解答:
解:X、Y、Z、W是元素周期表前四个周期中常见的元素,原子序数依次增大,由X形成的单质是最清洁的能源,则X为H元素;Y原子最外层有3个未成对电子,次外层只有一对成对电子,Y原子只能有2个电子层,核外电子排布为1s22s22p3,则Y为N元素;Z存在质量数为27,中子数为14的核素,则Z原子质子数=27-14=13,故Z为Al元素;W元素+3价离子3d能级为半充满,离子的核外电子排布为1s22s22p63s23p63d5,故W原子核外电子数=23+3=26,则W为Fe元素,
(1)N、H两元素按原子数目比为1:2和1:3构成分子A和B,则A为N2H4、B为NH3,N2H4分子中N原子之间形成1对共用电子对、H原子与N原子之间形成1对共用电子对,故其结构式为: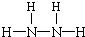 ,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为:
,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为: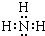 ,
,
故答案为: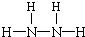 ;
;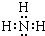 ;
;
(2)元素N、Al形成的化合物的化学式为AlN,该物质耐高温、强度高,是良好的耐热冲击材料,由此可推知它为原子晶体,
故答案为:AlN;原子;
(3)Z为Al元素,原子核外有3个电子层,最外层电子数为3,位于周期表中第三周期ⅢA族.一定量的Al单质在氢氧化钠溶液中反应时共转移了3mol电子,放出Q kJ热量,参加反应的Al的物质的量为1mol,则该反应的热化学方程式为:2Al(s)+2NaOH(aq)+2H2O(l)=2NaAlO2(aq)+3H2(g)△H=-2QkJ/mol,
故答案为:三;ⅢA;2Al(s)+2NaOH(aq)+2H2O(l)=2NaAlO2(aq)+3H2(g)△H=-2QkJ/mol;
(4)Fe2+电子排布式为1s22s22p63s23p63d6,向试管里氯化亚铁的水溶液中通入氧气,发现溶液呈黄色,且试管内壁有红褐色固体生成,反应生成铁离子、氢氧化铁沉淀,则该反应的离子方程式为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+,
故答案为:1s22s22p63s23p63d6;12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+.
(1)N、H两元素按原子数目比为1:2和1:3构成分子A和B,则A为N2H4、B为NH3,N2H4分子中N原子之间形成1对共用电子对、H原子与N原子之间形成1对共用电子对,故其结构式为:
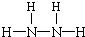 ,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为:
,NH3分子中N原子与H原子之间形成1对共用电子对,故其电子式为: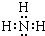 ,
,故答案为:
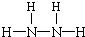 ;
;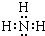 ;
;(2)元素N、Al形成的化合物的化学式为AlN,该物质耐高温、强度高,是良好的耐热冲击材料,由此可推知它为原子晶体,
故答案为:AlN;原子;
(3)Z为Al元素,原子核外有3个电子层,最外层电子数为3,位于周期表中第三周期ⅢA族.一定量的Al单质在氢氧化钠溶液中反应时共转移了3mol电子,放出Q kJ热量,参加反应的Al的物质的量为1mol,则该反应的热化学方程式为:2Al(s)+2NaOH(aq)+2H2O(l)=2NaAlO2(aq)+3H2(g)△H=-2QkJ/mol,
故答案为:三;ⅢA;2Al(s)+2NaOH(aq)+2H2O(l)=2NaAlO2(aq)+3H2(g)△H=-2QkJ/mol;
(4)Fe2+电子排布式为1s22s22p63s23p63d6,向试管里氯化亚铁的水溶液中通入氧气,发现溶液呈黄色,且试管内壁有红褐色固体生成,反应生成铁离子、氢氧化铁沉淀,则该反应的离子方程式为:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+,
故答案为:1s22s22p63s23p63d6;12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+.
点评:本题考查结构性质位置关系应用,涉及电子式、晶体类型与性质、热化学方程式、核外电子排布、离子方程式等,侧重学生对知识应用考查,难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、56g铁发生氧化还原反应,一定失去2NA个电子 |
| B、18gD2O含有的质子数为10NA |
| C、常温常压下,46 gNO2和N2O4的混合物中含有的原子数为3NA |
| D、1mol/L Na2CO3溶液中含有的Na+数目为2NA |
下列反应的离子方程式书写不正确的是( )
| A、氢氧化钠溶液和稀硫酸反应:H++OH-=H2O |
| B、氯化铝溶液加入过量氨水:Al3++3OH-=Al(OH)3↓ |
| C、碳酸钡溶于盐酸:BaCO3+2H+=Ba2++H2O+CO2↑ |
| D、氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
下列离子方程式书写正确的是( )
| A、盐酸与碳酸钡反应:CO32-+2H+═CO2↑+H2O |
| B、往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
| C、稀硫酸溶液与氨水反应:H++OH-═H2O |
| D、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
 A、B、C、D、E均为中学化学常见的物质,它们间的反应关系如下图所示.
A、B、C、D、E均为中学化学常见的物质,它们间的反应关系如下图所示.