题目内容
现欲配制0.5mol/L碳酸钠溶液100mL,然后向配制好的溶液中加入足量的稀盐酸.试计算:
(1)配制溶液需要碳酸钠固体的质量是多少?
(2)加入稀盐酸后生成的二氧化碳在标准状况下的体积是多少? .
(1)配制溶液需要碳酸钠固体的质量是多少?
(2)加入稀盐酸后生成的二氧化碳在标准状况下的体积是多少?
考点:配制一定物质的量浓度的溶液
专题:化学实验基本操作
分析:(1)根据100mL 0.5mol/L碳酸钠溶液中溶质碳酸钠的物质的量计算出需要碳酸钠固体的质量;
(2)根据碳原子守恒,生成二氧化碳的物质的量就等于溶液中溶质的物质的量,再根据标况下气体摩尔体积计算出生成的标况下的二氧化碳的体积.
(2)根据碳原子守恒,生成二氧化碳的物质的量就等于溶液中溶质的物质的量,再根据标况下气体摩尔体积计算出生成的标况下的二氧化碳的体积.
解答:
解:(1)100mL 0.5mol/L Na2CO3溶液中含有溶质碳酸钠的物质的量为:n(Na2CO3)=0.5mol/L×0.1L=0.05mol,需要碳酸钠固体的质量为:m(Na2CO3)=106g/mol×0.05mol=5.3g,
故答案为:5.3g;
(2)根据碳原子守恒,加入稀盐酸后生成的二氧化碳的物质的量等于碳酸钠的物质的量,即n(CO2)=n(Na2CO3)=0.05mol,
生成的标况下的二氧化碳的体积为:V(CO2)=22.4L/mol×0.05mol=1.12L,
故答案为:1.12L.
故答案为:5.3g;
(2)根据碳原子守恒,加入稀盐酸后生成的二氧化碳的物质的量等于碳酸钠的物质的量,即n(CO2)=n(Na2CO3)=0.05mol,
生成的标况下的二氧化碳的体积为:V(CO2)=22.4L/mol×0.05mol=1.12L,
故答案为:1.12L.
点评:本题考查了配制一定物质的量浓度的溶液的简单计算,题目难度不大,注意掌握配制一定物质的量浓度的溶液的方法,明确标况下气体摩尔体积的数值.

练习册系列答案
相关题目
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A、Na+、Cl-、CO32-、SO32- |
| B、K+、ClO-、Cl-、SO42- |
| C、Ca2+、Mg2+、NO3-、HCO3- |
| D、NH4+、Ba2+、Cl-、NO3- |
设NA为阿伏加德罗常数的值.下列说法中正确的是( )
| A、在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA |
| B、标准状况下,22.4L的CCl4分子中含有共价键数为4NA |
| C、常温常压下,1mol NaHSO4晶体中含有2NA个离子 |
| D、电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA |
下列有关实验的说法正确的是( )
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、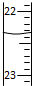 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
 2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.
2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.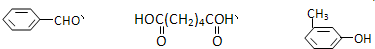
 互为同分异构体的是
互为同分异构体的是