题目内容
11.将5.5g铁铝混合物粉末加入过量的1L1mol/L HNO3溶液中,充分反应后,得3.36L(标准状况)NO气体,求(1)假设反应前后溶液的体积不变,剩余硝酸的浓度为0.4mol/L
(2)混合物中铝的质量分数为49.1%,
(3)向反应后的溶液中加入850 mL 1mol/L NaOH溶液时,生成的沉淀量最大,再加100 mL 1mol/L NaOH溶液才能使沉淀的量不再发生变化.
分析 (1)同质量的铝消耗硝酸的量多,假设5.5g金属全部是铝,由Al+4HNO3=Al(NO3)3+NO↑+2H2O,可知需要硝酸 $\frac{5.5g}{27g/mol}$×4=0.81 mol,硝酸物质的量为1L×1mol/L=1mol>0.81 mol,所硝酸过量,设铝、铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y=$\frac{3.36}{22.4}$×3,联立方程解得:x=0.1 y=0.05,所以消耗硝酸的物质的量为:(0.1+0.05)×3+$\frac{3.36}{22.4}$=0.6mol,所以剩余硝酸的物质的量1mol-0.6mol=0.4mol,根据c=$\frac{n}{V}$进行计算求解;
(2)铝的质量分数为:$\frac{0.1mol×27g/mol}{5.5g}$×100%=49.1%;
(3)要使沉淀的量不随NaOH溶液量的变化而变化,则最终溶液中溶质为NaNO3、NaAlO2,根据钠离子守恒:n(NaOH)=n(NaNO3)+n(NaAlO2),再结合N原子、Al原子守恒计算n(NaOH),进而计算此时需要氢氧化钠溶液体积;
要使生成的沉淀量最大,最后得到的溶液是中溶质为NaNO3,根据钠离子守恒:n(NaOH)=n(NaNO3),再结合N原子守恒计算n(NaOH),进而计算此时需要氢氧化钠溶液体积.
解答 解:(1)同质量的铝消耗硝酸的量多,假设5.5g金属全部是铝,由Al+4HNO3=Al(NO3)3+NO↑+2H2O,可知需要硝酸 $\frac{5.5g}{27g/mol}$×4=0.81 mol,硝酸物质的量为1L×1mol/L=1mol>0.81 mol,所硝酸过量,设铝、铁的物质的量分别为:xmol、ymol,根据质量守恒得27x+56y=5.5;得失电子守恒得(硝酸过量铁变成三价铁):3x+3y=$\frac{3.36}{22.4}$×3,联立方程解得:x=0.1 y=0.05,所以消耗硝酸的物质的量为:(0.1+0.05)×3+$\frac{3.36}{22.4}$=0.6mol,所以剩余硝酸的物质的量1mol-0.6mol=0.4mol,所以剩余硝酸的浓度为$\frac{0.4mol}{1L}$=0.4mol/l,
故答案为:0.4;
(2)铝的质量分数为:$\frac{0.1mol×27g/mol}{5.5g}$×100%=49.1%,故答案为:49.1;
(3)要使沉淀的量不随NaOH溶液量的变化而变化,则最终溶液中溶质为NaNO3、NaAlO2,根据钠离子守恒:n(NaOH)=n(NaNO3)+n(NaAlO2),再结合N原子、Al原子守恒,n(NaOH)=1mol-$\frac{3.36L}{22.4L/mol}$+0.1mol=0.95mol,此时需要氢氧化钠溶液体积为$\frac{0.95mol}{1mol/L}$=0.95L=950mL;
要使生成的沉淀量最大,最后得到的溶液是中溶质为NaNO3,根据钠离子守恒:n(NaOH)=n(NaNO3)=1mol-$\frac{3.36L}{22.4L/mol}$=0.85mol,此时需要氢氧化钠溶液体积为$\frac{0.85mol}{1mol/L}$=0.85L=850mL,所以再加入950mL-850mL=100mL,
故答案为:850;100.
点评 本题考查混合物的计算,难度中等,侧重对解题方法计算与学生分析思维能力考查,涉及过量计算、极端思考、守恒关系的应用.


| A. | 该反应的△H<0,△S>0 | |
| B. | 途径Ⅱ与途径I相比,可能是加了催化剂 | |
| C. | 其他条件相同时,产生相同体积的氧气时放出的热量:途径I>途径Ⅱ | |
| D. | 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ |
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
| A. | 乙醛和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
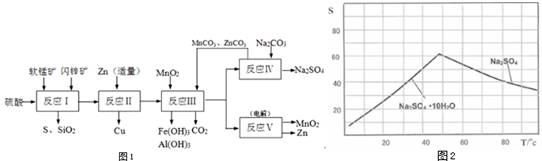
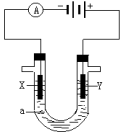 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题: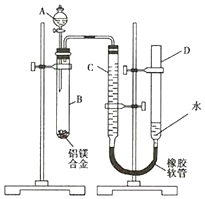 某学习小组用如图装置测定镁铝合金中铝的质量分数.
某学习小组用如图装置测定镁铝合金中铝的质量分数. 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.