题目内容
10.有机物 的所有同分异构体中属于酯类的同分异构体共有几种( )
的所有同分异构体中属于酯类的同分异构体共有几种( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析  的分子式为C3H6O2,属于酯类的有机物分子中含有羧基(-COOH),可以表示为C2H5-COOH,则满足条件的同分异构体的数目取决于-C2H5的结构,据此进行解答.
的分子式为C3H6O2,属于酯类的有机物分子中含有羧基(-COOH),可以表示为C2H5-COOH,则满足条件的同分异构体的数目取决于-C2H5的结构,据此进行解答.
解答 解:有机物 的分子式为C3H6O2,与该有机物互为同分异构体且属于酯类,则满足条件的有机物可表示为C2H5-COOH,由于-C2H5不存在同分异构体,且具有对称结构,则C2H5-COOH只有1种结构,
的分子式为C3H6O2,与该有机物互为同分异构体且属于酯类,则满足条件的有机物可表示为C2H5-COOH,由于-C2H5不存在同分异构体,且具有对称结构,则C2H5-COOH只有1种结构,
故选A.
点评 本题考查了同分异构体的判断,题目难度不大,明确同分异构体的概念及书写原则为解答关键,试题侧重考查学生的分析能力及逻辑推理能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.如图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是( )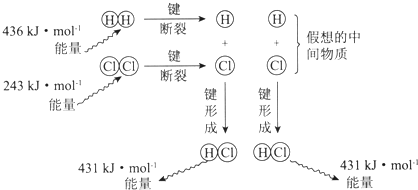

| A. | 该反应的反应热△H=-183kJ•mol-1 | |
| B. | 该反应生成液态HCl比生成气态HCl释放的能量少 | |
| C. | 氯气分子中的化学键比氢气分子中的化学键更稳定 | |
| D. | 1 mol HCl分子中的化学键形成时吸收431kJ的能量 |
18.水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(5)己知:
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而增大(填增大/减小/不变);
(2)关于该反应的下列说法中,正确的是A;
A.△H>0,△S>0B.△H>0,△S<0C.△H<0,△S>0D.△H<0,△S<0
(3)上述反应达到平衡后,将体系中的C (s)全部移走,平衡左移(向左移/向右移/不移动);
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
2C (s)+O2(g)=2CO (g)△H=-221.0kJ•mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
若将24g炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为-787.0kJ/mol.
5.实验室需配制480mL 0.1mol•L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
(1)配制480mL 0.1mol•L-1的Na2CO3溶液.
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1cm~2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)若容量瓶中有少量蒸馏水无影响;若定容时俯视刻度线偏高.
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度重新配制.
2.在下列反应中,既属于离子反应又属于氧化还原反应的是( )
| A. | BaCl2溶液和K2SO4溶液反应 | B. | Al放入烧碱溶液中 | ||
| C. | NaOH溶液和CuSO4溶液反应 | D. | KSCN溶液和FeCl3溶液反应 |
19.25℃时,浓度均为0.1mol•L-1HCl和CH3COOH各10mL,下列说法正确的是( )
| A. | 两溶液的导电能力和pH值均相同 | |
| B. | 中和两溶液,消耗NaOH的物质的量相同 | |
| C. | 分别与足量的Zn完全反应,盐酸产生的速率快,氢气多 | |
| D. | 当把两种酸各10mL混合后,加10mL 0.1mol•L-1的NaOH,则有c(H+)=c(CH3COO-) |
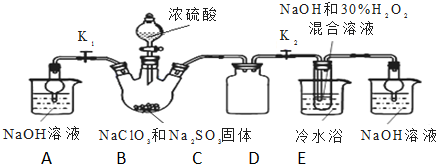
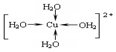 .
.