题目内容
16.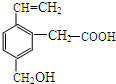 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )①可以燃烧;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应.
| A. | ①②④ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ①②④⑥ |
分析 该物质中含有苯环、碳碳双键、醇羟基和羧基,具有苯、烯烃、醇和羧酸的性质,能发生加成反应、取代反应、氧化反应、加聚反应、中和反应、酯化反应等,据此分析解答.
解答 解:①为有机物,可以燃烧,故正确;
②碳碳双键能被酸性高锰酸钾溶液氧化而能使酸性KMnO4溶液褪色,故正确;
③含有羧基,具有酸性,能跟NaOH溶液反应生成羧酸钠和水,故正确;
④含有羧基和醇羟基,所以能发生酯化反应,故正确;
⑤含有碳碳双键,所以能发生加聚反应,故正确;
⑥不含酯基或卤原子,所以不能发生水解反应,故错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇和羧酸性质,注意该醇醇羟基不能发生消去反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.短周期元素A、B、C在元素周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
| A | C | |
| B |
| A. | A、B、C三元素的气态氢化物溶于水均显酸性 | |
| B. | A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | C在周期表中的位置为第二周期第ⅦA族,最高价为+7价 | |
| D. | B02是酸性氧化物,AO2不是酸性氧化物 |
7.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| C. | 6.4g铜与足量的硫磺在绝隔空气的条件下反应,电子转移的数目为0.1NA | |
| D. | 1mol白磷分子中所含共价键数为4NA |
11.对图两种化合物的结构或性质描述错误的是( )
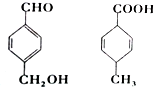

| A. | 均可以发生加成和取代反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 互为同分异构体 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
1.把0.1mol MgCl2固体溶于水配成100mL溶液,此溶液中Cl-的物质的量浓度为( )
| A. | 3.Omol•L-1 | B. | 2.Omol•L-1 | C. | O.3mol•L-1 | D. | O.2mol•L-1 |
8.下列选项不正确的是( )
| A. | 从碘水中提取碘的方法是萃取 | |
| B. | 物质的量浓度的单位是mol/L | |
| C. | 胶体与溶液的本质区别是丁达尔效应 | |
| D. | 氧化还原反应的实质是电子的转移 |
 .
.