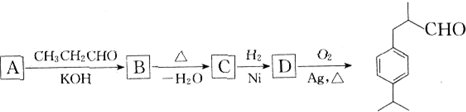
题目内容
现测得二氧化碳在空气中的含量为0.038%,当其含量超过0.05%时就会加剧温室效应.所以人们一方面想限制其排放量,另一方面又想对它进行再利用.

(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于 .
(2)有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃 料甲醇(CH3OH).该技术流程如下:(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂.)
①合成塔中反应的化学方程式为 .
②请在上述流程图中找出循环利用的物质(标出物质名称和循环方向).
③如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?并简述理由 .
④若生产4.8吨甲醇,则可回收空气中的CO2 吨.

(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于
(2)有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃 料甲醇(CH3OH).该技术流程如下:(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂.)
①合成塔中反应的化学方程式为
②请在上述流程图中找出循环利用的物质(标出物质名称和循环方向).
③如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?并简述理由
④若生产4.8吨甲醇,则可回收空气中的CO2
考点:物质分离和提纯的方法和基本操作综合应用,化学方程式的有关计算
专题:元素及其化合物
分析:(1)氟利昂能破坏臭氧层,用二氧化碳代替氟利昂能作致冷剂保护臭氧层;
(2)①根据题中给出的条件,二氧化碳被吸收又分解生成;最后和氢气在合成塔变为燃料甲醇(CH3OH),经配平即可得化学方程式;
②根据提示可以看出:吸收池中盛有饱和的K2CO3溶液吸收二氧化碳生成KHCO3;在分解池中KHCO3又分解生成K2CO3;所以碳酸钾被循环利用;
③空气中的二氧化碳含量太低,不利于生成甲醇的反应进行.通过吸收池和分解池是为了加大二氧化碳的浓度;
④利用方程式CO2 +3H2═CH3OH+H2O计算即可.
(2)①根据题中给出的条件,二氧化碳被吸收又分解生成;最后和氢气在合成塔变为燃料甲醇(CH3OH),经配平即可得化学方程式;
②根据提示可以看出:吸收池中盛有饱和的K2CO3溶液吸收二氧化碳生成KHCO3;在分解池中KHCO3又分解生成K2CO3;所以碳酸钾被循环利用;
③空气中的二氧化碳含量太低,不利于生成甲醇的反应进行.通过吸收池和分解池是为了加大二氧化碳的浓度;
④利用方程式CO2 +3H2═CH3OH+H2O计算即可.
解答:
解:(1)氟利昂能破坏臭氧层,用二氧化碳代替氟利昂能保护臭氧层.
故答案为:起到保护臭氧层的作用;
(2)①根据题中给出的条件,二氧化碳最后又被重新吸收,且在最后和氢气在合成塔变为燃料甲醇(CH3OH),所以经配平得化学方程式为CO2+3H2
CH3OH+H2O.
故答案为:CO2+3H2
CH3OH+H2O;
②根据提示可以看出:吸收池中盛有饱和的K2CO3溶液吸收二氧化碳生成KHCO3;在分解池中KHCO3又分解生成;所以碳酸钾被循环利用.
故答案为: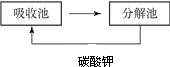
③空气中的二氧化碳含量太低,不利于生成甲醇的反应进行.通过吸收池和分解池是为了加大二氧化碳的浓度,之后再通入合成塔.
故答案为:不行、如果直接通入合成塔,由于空气中CO2的含量太低了,不利于生成甲醇的反应进行;
④利用①的方程式去求
CO2 +3H2═CH3OH+H2O
44 32
X 4.8t
44:32=X:4.8t
X=6.6t
故答案为:6.6.
故答案为:起到保护臭氧层的作用;
(2)①根据题中给出的条件,二氧化碳最后又被重新吸收,且在最后和氢气在合成塔变为燃料甲醇(CH3OH),所以经配平得化学方程式为CO2+3H2
| ||
| 催化剂 |
故答案为:CO2+3H2
| ||
| 催化剂 |
②根据提示可以看出:吸收池中盛有饱和的K2CO3溶液吸收二氧化碳生成KHCO3;在分解池中KHCO3又分解生成;所以碳酸钾被循环利用.
故答案为:

③空气中的二氧化碳含量太低,不利于生成甲醇的反应进行.通过吸收池和分解池是为了加大二氧化碳的浓度,之后再通入合成塔.
故答案为:不行、如果直接通入合成塔,由于空气中CO2的含量太低了,不利于生成甲醇的反应进行;
④利用①的方程式去求
CO2 +3H2═CH3OH+H2O
44 32
X 4.8t
44:32=X:4.8t
X=6.6t
故答案为:6.6.
点评:本题考查了物质的分离、提纯、富集、合成、方程式的计算等方面知识,涉及面较广但难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列离子方程式正确的是( )
| A、亚硫酸钠跟硫酸反应:SO32-+2H+═SO2↑+H2O |
| B、铁跟三氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
| C、硫化亚铁跟盐酸反应:2H++S2-═H2S↑ |
| D、碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O |
 [化学--选修物质结构与性质]
[化学--选修物质结构与性质] ,由短周期元素构成的与SO
,由短周期元素构成的与SO
 )在食品、化妆品等工业中用作香料添加剂.其合成流程为(部分产物及反应条件已略去,键线式参见本试卷第12题):
)在食品、化妆品等工业中用作香料添加剂.其合成流程为(部分产物及反应条件已略去,键线式参见本试卷第12题):