题目内容
 [化学--选修物质结构与性质]
[化学--选修物质结构与性质]H2O2的制备可采用如下4种方法:方法一:BaO2+H2SO4=BaSO4↓+H2O2方法二:2KHSO4
| ||
| ||
方法四:乙基蒽醌法:(如图1)
回答相关问题
(1)BaO2与CaO两者熔点较高的是
(2)KHSO4在熔融状态下的电离方程式为
 ,由短周期元素构成的与SO
,由短周期元素构成的与SO2- 4 |
(3)方法三得到的丙酮分子H3CCOCH3中,共平面的原子最多有
(4)上述四种方法中原子利用率最高的是
(5)H2O2与H2S的相对分子量相近,但H2O2的水溶性和沸点明显大于H2S,其主要原因是
考点:晶胞的计算,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:化学键与晶体结构
分析:(1)微粒越小、离子所带电荷越多,晶格能越大,熔点越高;由BaO2的晶胞可知,以顶角的Ba2+为研究对象,与之距离相等且最近的Ba2+位于面心,而每个顶角为12个面共用;该晶胞中离子配位数为6,与NaCl晶体结构相似;
(2)KHSO4属于离子化合物,由钾离子与硫酸氢根离子构成,熔融状态下的电离出钾离子与硫酸氢根离子;
原子总数、价电子总数都相等的微粒互为等电子体,1个S原子与1的单位负电荷用Cl原子代替,可得其一价阴离子等电子体;
H2S2O8分子中硫原子的杂化类型与中的硫原子类型相同,分子中还存在过氧键,其结构相当于2分子硫酸脱去1分子水得到;
(3)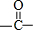 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于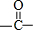 平面内;
平面内;
(4)由图1可知,乙基蒽醌法中,纵观整个过程,相当于氢气与氧气结合得到H2O2,原子利用率最高;
(5)根据氢键分析解答.
(2)KHSO4属于离子化合物,由钾离子与硫酸氢根离子构成,熔融状态下的电离出钾离子与硫酸氢根离子;
原子总数、价电子总数都相等的微粒互为等电子体,1个S原子与1的单位负电荷用Cl原子代替,可得其一价阴离子等电子体;
H2S2O8分子中硫原子的杂化类型与中的硫原子类型相同,分子中还存在过氧键,其结构相当于2分子硫酸脱去1分子水得到;
(3)
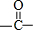 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于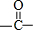 平面内;
平面内;(4)由图1可知,乙基蒽醌法中,纵观整个过程,相当于氢气与氧气结合得到H2O2,原子利用率最高;
(5)根据氢键分析解答.
解答:
解:(1)BaO2与CaO都属于离子晶体,离子所带电荷相等,离子半径Ba2+>Ca2+,过氧根离子比阳离子大,故CaO的晶格能较大,熔点比BaO2高;
由BaO2的晶胞可知,以顶角的Ba2+为研究对象,与之距离相等且最近的Ba2+位于面心,而每个顶角为12个面共用,故晶体中与每个Ba2+距离相等且最近的Ba2+共有12个;
该晶胞中离子配位数为6,与NaCl晶体结构相似,
故答案为:CaO;12;NaCl;
(2)KHSO4属于离子化合物,由钾离子与硫酸氢根离子构成,熔融状态下的电离出钾离子与硫酸氢根离子,电离方程式为:KHSO4(熔融)=K++HSO4-;
原子总数、价电子总数都相等的微粒互为等电子体,1个S原子与1的单位负电荷用Cl原子代替,可得其一价阴离子等电子体为ClO4-;
H2S2O8分子中硫原子的杂化类型与中的硫原子类型相同,分子中还存在过氧键,其结构相当于2分子硫酸脱去1分子水得到,故H2S2O 8分子的结构式为: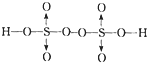 ;
;
故答案为:KHSO4(熔融)=K++HSO4-;ClO4-; ;
;
(3)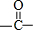 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于 平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),
平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),
故答案为:6;
(4)由图1可知,乙基蒽醌法中,纵观整个过程,相当于氢气与氧气结合得到H2O2,原子利用率最高,其它方法中H、O元素没有充分利用,
故答案为:方法四;
(5)H2O2与水分子之间能形成氢键,H2O2分子间也能形成氢键,故H2O2的水溶性和沸点明显大于H2S,
故答案为:H2O2与水分子之间能形成氢键,故其溶解度大;H2O2分子间也能形成氢键,故其沸点高.
由BaO2的晶胞可知,以顶角的Ba2+为研究对象,与之距离相等且最近的Ba2+位于面心,而每个顶角为12个面共用,故晶体中与每个Ba2+距离相等且最近的Ba2+共有12个;
该晶胞中离子配位数为6,与NaCl晶体结构相似,
故答案为:CaO;12;NaCl;
(2)KHSO4属于离子化合物,由钾离子与硫酸氢根离子构成,熔融状态下的电离出钾离子与硫酸氢根离子,电离方程式为:KHSO4(熔融)=K++HSO4-;
原子总数、价电子总数都相等的微粒互为等电子体,1个S原子与1的单位负电荷用Cl原子代替,可得其一价阴离子等电子体为ClO4-;
H2S2O8分子中硫原子的杂化类型与中的硫原子类型相同,分子中还存在过氧键,其结构相当于2分子硫酸脱去1分子水得到,故H2S2O 8分子的结构式为:
 ;
;故答案为:KHSO4(熔融)=K++HSO4-;ClO4-;
 ;
;(3)
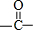 中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于
中C原子成3个σ键,没有孤电子对,为平面结构,旋转C-C单键可以使甲基中的1个氢原子处于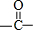 平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),
平面内,故H3CCOCH3中,共平面的原子最多有6个(3个C原子、1个O原子、2个H原子),故答案为:6;
(4)由图1可知,乙基蒽醌法中,纵观整个过程,相当于氢气与氧气结合得到H2O2,原子利用率最高,其它方法中H、O元素没有充分利用,
故答案为:方法四;
(5)H2O2与水分子之间能形成氢键,H2O2分子间也能形成氢键,故H2O2的水溶性和沸点明显大于H2S,
故答案为:H2O2与水分子之间能形成氢键,故其溶解度大;H2O2分子间也能形成氢键,故其沸点高.
点评:本题是对物质结构的考查,题目比较综合,涉及熔点比较、晶体结构、分子结构与性质、等电子体、氢键等,侧重考查学生对知识的迁移应用、分析解决问题的能力,难度中等,注意对知识的全面掌握.

练习册系列答案
相关题目
LiFePO4新型锂离子电池因其原材料丰富、对环境友好、循环性能和安全性能好的特点,具有广阔的应用前景.已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+,下列说法中正确的是( )
| A、充电时阳极反应为Li++e-=Li |
| B、充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C、放电时电池内部Li+向负极移动 |
| D、放电时,在正极上是Li+得电子被还原 |
下列物质的水溶液pH大于7的是( )
| A、Na2CO3 |
| B、(NH4)2SO4 |
| C、KNO3 |
| D、CH3CH2OH |
下列反应的离子方程式书写正确的是( )
| A、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+2H2O |
| D、铁跟稀硫酸反应:Fe+2H+═Fe3++H2↑ |
下列离子方程式正确的是( )
| A、NaHCO3水解时的离子方程式:HCO3-+H2O?H3O++CO32- |
| B、AgCl溶于水时形成的溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
| C、少量的CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- |
| D、向NaHSO4溶液中滴加过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |




 ,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为
,如果E→H的反应在一定条件下也能实现的话,请你预测所得高分子感光树脂单体H 的最简单的结构简式为