题目内容
14.氯化铵常用作焊接.如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:4CuO+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+1CuCl2+1N2↑+4H2O
①配平此氧化还原反应方程式;
②此反应中若产生0.2mol的气体,则有1.2mol的电子转移.
分析 ①Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒分析;
②由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6mol=1.2mol,由此解答.
解答 解:①Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒可知,反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,故答案为:4;2;3;1;1;4;
②由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6mol=1.2mol,故答案为:1.2.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.核磁共振(NMR)技术已经广泛应用于分子结构的测定等领域.已知只有质子数或中子数为奇数的原子核才有NMR现象,下列能产生NMR现象的原子是( )
| A. | 32 S | B. | 4 He | C. | 14 N | D. | 32 Si |
9.下列叙述正确的是( )
| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
19.有关下图所示化合物的说法不正确的是( )


| A. | 1mol该化合物最多可以与3molNaOH反应 | |
| B. | 既可以与Br2的CCl4溶液发生加成反应,又可在光照下与Br2发生取代反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可与NaHCO3溶液反应放出CO2气体 |
6.X、Y、Z、G、W为原子序数依次增大的5种短周期主族元素.X的质子数与电子层数相同,Y、Z、G同周期且相邻,W原子核外电子数是G原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、G 三种元素形成六核化合物乙.下列说法错误的是( )
| A. | 化合物乙中只有共价键 | |
| B. | 甲可与Z和X形成的某种化合物反应生成强酸 | |
| C. | W的氧化物只能与碱反应,不能与任何酸反应 | |
| D. | X分别与Y、Z、G、W形成的气态化合物中,稳定性最好的是XG |
4.下列说法中正确的是( )
| A. |  的名称:2-甲基乙醇 的名称:2-甲基乙醇 | B. | 聚丙烯的链节: | ||
| C. | 甲酸甲酯的结构简式:C2H4O2 | D. | 比例模型为 的分子可发生加成反应 的分子可发生加成反应 |
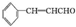 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: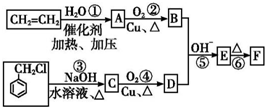

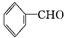 ;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.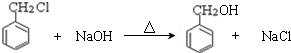 .
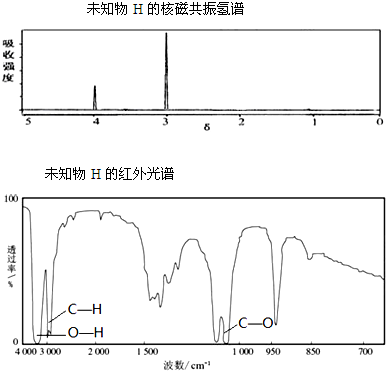
.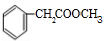 .
.
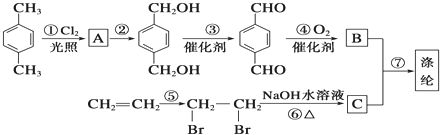
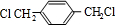 ,B
,B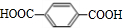 ,CHOCH2CH2OH.
,CHOCH2CH2OH. .
.