题目内容
20.按要求完成下列填空(1)写出下列物质的电离方程式:
Fe2(SO4)3Fe2(SO4)3=2Fe3++3SO42-,NaHCO3NaHCO3=Na++HCO3-;
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应CaCO3+2H+=Ca2++CO2↑+H2O,
氢氧化钡溶液与稀硫酸反应Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)写出与下列离子方程式相对应的化学方程式:
H++OH-═H2OHCl+NaOH=NaCl+H2O,
CO32-+2H+═CO2↑+H2ONa2CO3+2HCl═CO2↑+H2O+2NaCl.
(4)鉴别NaCl和Na2CO3溶液的试剂是氯化钙溶液,离子方程式为Ca2++CO32-=CaCO3↓
(5)除去Fe粉中少量Al粉杂质的试剂是氢氧化钠溶液,离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 (1)硫酸铁为强电解质,完全电离出铁离子和硫酸根离子;碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子;
(2)盐酸与碳酸钙反应生成氯化钙和水;
氢氧化钡与硫酸反应生成硫酸钡和水;
(3)H++OH-═H2O课表上盐酸与氢氧化钠反应;
CO32-+2H+═CO2↑+H2O可以表示碳酸钠与盐酸反应;
(4)氯化钙能与碳酸钠反应生成碳酸钙沉淀,氯化钠与氯化钙不反应;
(5)铝能够与氢氧化钠反应生成可溶性偏铝酸钠而溶解,铁与氢氧化钠不反应,过滤即可除去铝.
解答 解:(1)硫酸铁为强电解质,完全电离出铁离子和硫酸根离子,电离方程式:Fe2(SO4)3=2Fe3++3SO42-;碳酸氢钠为强电解质,完全电离生成钠离子和碳酸氢根离子,电离方程式:NaHCO3=Na++HCO3-;
故答案为:Fe2(SO4)3=2Fe3++3SO42-;NaHCO3=Na++HCO3-;
(2)盐酸与碳酸钙反应生成氯化钙和水,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O,氢氧化钡与硫酸反应生成硫酸钡和水,离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)H++OH-═H2O课表上盐酸与氢氧化钠反应,化学方程式:HCl+NaOH=NaCl+H2O;
CO32-+2H+═CO2↑+H2O可以表示碳酸钠与盐酸反应,化学方程式:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
故答案为:HCl+NaOH=NaCl+H2O;Na2CO3+2HCl═CO2↑+H2O+2NaCl;
(4)氯化钙能与碳酸钠反应生成碳酸钙沉淀,反应离子方程式:Ca2++CO32-=CaCO3↓,氯化钠与氯化钙不反应,所以可以用氯化钙检验氯化钠和碳酸钠;
故答案为:氯化钙溶液;Ca2++CO32-=CaCO3↓;
(5)铝能够与氢氧化钠反应生成可溶性偏铝酸钠而溶解,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,铁与氢氧化钠不反应,过滤即可除去铝;
故答案为:氢氧化钠溶液;2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题为综合题,考查了电解质电离方程式书写,离子反应方程式书写,物质的检验、物质的鉴别和除杂,熟悉物质的性质及发生反应的实质是解题关键,题目难度不大.

| A. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| B. | 因为氢氧化铁胶体具有吸附性,所以常用于净水 | |
| C. | 因为液态HCl不导电,所以HCl是非电解质 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
| A. | 盐酸用量偏大,生成CO2气体的量偏大 | |
| B. | 盐酸用量偏大,生成CO2气体的量偏小 | |
| C. | 盐酸用量偏小,生成CO2气体的量偏大 | |
| D. | 盐酸用量偏小,生成CO2气体的量偏小 |
| A. | CH3CH(CH2Br)2 | B. | (CH3)2BrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表,V1=20mL.
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请完成假设2和假设3:
假设1:Fe2+起催化作用;
假设2:Al3+起催化作用;
假设3:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成表中内容.(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
 有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子有3能级,且有3个未成对电子;D的最外层电子数是内层电子数的3倍.基态的E是前四周期中未成对电子数最多的原子.
有A、B、C、D、E是前四期的元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子有3能级,且有3个未成对电子;D的最外层电子数是内层电子数的3倍.基态的E是前四周期中未成对电子数最多的原子. .
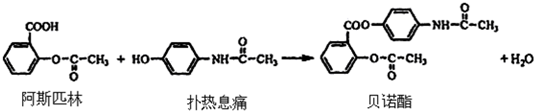
.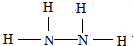 .
.
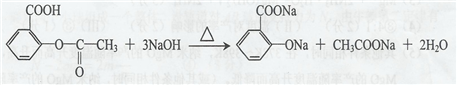 .
.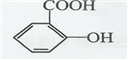 .
.