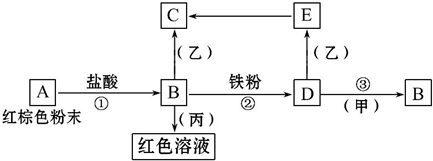
��Ŀ����
8���ϳɰ���Ӧ�ǻ�ѧ������Ҫ�ķ�Ӧ����1���ϳɰ�ԭ�����е�������������Ȼ������Ҫ�ɷ�ΪCH4���ڸ��¡�������������ˮ������Ӧ�Ƶã���Ӧ��ÿ����2mol CO2����316kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+158kJ/mol���÷����Ƶõ�ԭ��������Ҫ������CO2������K2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽ��CO32-+CO2+H2O=2HCO3-��
��2����֪N2��g��+3H2��g��?2����3��g����H��0��ͼ�ǵ���Ӧ���а�n��N2����n��H2��=1��3Ͷ�Ϻ���200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����ʵ���������ѹǿ�ı仯���ߣ�
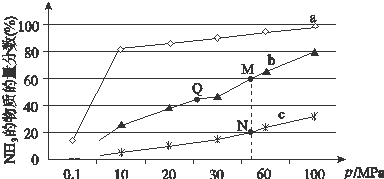
������a��Ӧ���¶���200�森
�ڹ��ڹ�ҵ�ϳɰ��ķ�Ӧ������������ȷ����AB������ţ�
A��ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵΪK��M��=K��Q����K��N��
B���Ӵ����ܼӿ췴Ӧ���ʵ�H2��ƽ��ת���ʲ���
C����ͬѹǿ�£�Ͷ����ͬ���ﵽƽ������ʱ���ϵΪc��b��a
D��������a��֪����ѹǿ���ӵ�100MPa���ϣ�NH3�����ʵ��������ɴﵽ100%
��N��ʱc��NH3��=0.2mol•L-1��N��Ļ�ѧƽ�ⳣ��K=$\frac{25}{27}$���÷�����ʾ����
��3���ϳɰ���ҵ�к�����ˮ�Ĵ�������֮һ�ǵ绯ѧ���������������ļ��Է�ˮͨ����ϵͳ���������ϰ��������ɵ������ѳ��������ĵ缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
��4��NH3 ���Դ���NO2 ����Ⱦ������ʽ���£�NO2+NH3$?_{����}^{����}$N2+H2O��δ��ƽ����ת��0.6mol����ʱ�����ĵ�NO2�ڱ�״������4.48L��
���� ��1��CH4�ڸ��¡�������������ˮ������Ӧ�ķ���ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g��������2mol CO2����316kJ��������1molCH4���ӷ�Ӧʱ��Ҫ���յ�����Ϊ158kJ��CO2��K2CO3��Һ��Ӧ����̼�����Ƽأ��ݴ˴��⣻
��2��������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ��������ĺ�����С��
��A��Kֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��
B���Ӵ����ܼӿ췴Ӧ���ʵ�ƽ�ⲻ�ƶ���
C����ͬѹǿ�£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣�
D���÷�ӦΪ���淴Ӧ����Ӧ��ת���ʲ����ܴﵽ100%��
�۸��ݷ�ӦN2��g��+3H2��g��?2NH3��g����������ʽ�����ƽ��ʱ�����ʵ�Ũ�ȣ�������ƽ�ⳣ����
��3�����ɵ�����Ⱦ������Ϊ���������ݵ��ԭ��д�������缫��Ӧʽ��
��4����Ӧ6NO2+8NH3$?_{����}^{����}$7N2+12H2O����ʽ��֪8NH3����24mole-���Դ������
��� �⣺��1��CH4�ڸ��¡�������������ˮ������Ӧ�ķ���ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g��������2mol CO2����316kJ��������1molCH4���ӷ�Ӧʱ��Ҫ���յ�����Ϊ158kJ�����Է�Ӧ���Ȼ�ѧ����ʽ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+158kJ/mol��CO2��K2CO3��Һ��Ӧ����̼�����Ƽأ���Ӧ�����ӷ���ʽΪCO32-+CO2+H2O=2HCO3-��
�ʴ�Ϊ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+158kJ/mol��CO32-+CO2+H2O=2HCO3-��
��2���ٺϳɰ��ķ�ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ�ߣ�Խ�����ڷ�Ӧ������У�����a�İ��������ʵ���������ߣ��䷴Ӧ�¶ȶ�Ӧ�����ͣ�����a���߶�Ӧ�¶�Ϊ200��C��
�ʴ�Ϊ��200�棻
��A��Kֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬����K��M��=K��Q��������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��Q����¶ȵ���N������K��Q����K��N������A��ȷ��
B���Ӵ����ܼӿ췴Ӧ���ʵ�ƽ�ⲻ�ƶ�������H2��ƽ��ת���ʲ��䣬��B��ȷ��
C����ͬѹǿ�£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣�cba���¶����ν��ͣ����Դﵽƽ������ʱ���ϵΪa��b��c����C����
D���÷�ӦΪ���淴Ӧ����Ӧ��ת���ʲ����ܴﵽ100%����D����
��ѡ��AB��
��N��ʱ�������ʵ����ķ���Ϊ20%����������ʽ����N2ת������b��N2����ʼŨ��Ϊa��
���ݷ�ӦN2��g��+3H2��g��?2NH3��g��
��ʼ a 3a 0
ת�� ab 3ab 2ab
ƽ�� a-ab 3a-3ab 2ab
����������$\left\{\begin{array}{l}{\frac{2ab}{a-ab+3a-3ab+2ab}=20%}\\{2ab=0.2mol•L{\;}^{-1}}\end{array}\right.$������a=0.3mol•L-1��b=$\frac{1}{3}$������ƽ�ⳣ��K=$\frac{��2ab��{\;}^{2}}{��a-ab��•��3a-3ab��^{3}}$=$\frac{25}{27}$��
�ʴ�Ϊ��$\frac{25}{27}$��
��3�����õ�ⷨ��NH3•H2Oת��Ϊ�Ի�������Ⱦ������Ϊ����������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
��4����Ӧ6NO2+8NH3$?_{����}^{����}$7N2+12H2O����ʽ��֪8NH3����24mole-���������ĵ�NH3�ڱ�״���µ������$\frac{0.6}{24}$��8��22.4L=4.48L��
�ʴ�Ϊ��4.48��
���� ���⿼�����Ȼ�ѧ����ʽ����д����ѧƽ��ļ��㡢����ԭ����������ԭ��Ӧ�ļ���ȣ���Ŀ�Ѷ��еȣ�ע����������ʽ���л�ѧƽ��ļ��㣬��ȷ��Ӧ���ʵĸ�����㷽��������������ѧ���ķ�����������������ѧ����������

 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�| A�� | ���Ӱ뾶�ɴ�С��Z2-��X+��Y3+��W2- | |
| B�� | ��̬�⻯����ȶ��ԣ�H2Wǿ��H2Z | |
| C�� | ��ҵ�ϳ����õ�ⷨұ��Y ���� | |
| D�� | W��X �γɵĻ����������������Ӹ�����һ����1��2 |
| A�� |  | B�� |  | C�� | 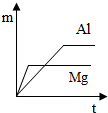 | D�� | 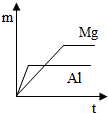 |
| A�� | ����ȼ�ϵ�ص�������ӦʽΪH2+2OH--2e-�T2H2O | |
| B�� | �ò��缫�������ͭ��Һ��������ӦʽΪ4OH--4e-�TO2��+2H2O | |
| C�� | ��ʾ������NaOH��ϡ��Һ��Ӧ���к��ȵĻ�ѧ����ʽΪH+��aq��+OH-��aq���TH2O��l����H=-57.3kJ��mol-1 | |
| D�� | NaHSO3����ˮʱˮ������ӷ���ʽΪHSO3-+H2O?SO32-+H3O+ |
| A�� | 0.5 mol•L-1 | B�� | 0.4 mol•L-1 | C�� | 0.3 mol•L-1 | D�� | 0.2 mol•L-1 |
| A�� | Na | B�� | FeCl3 | C�� | Al | D�� | Cu |
| A�� | C2H5Br��NaOH��Һ��Ϲ��� | |
| B�� | �Ҵ���NaOH��Һ��Ϲ��� | |
| C�� | һ�嶡�����NaOH�Ķ�����Һ��Ϲ��� | |
| D�� | �ȱ���NaOH��Һ��Ϲ��� |