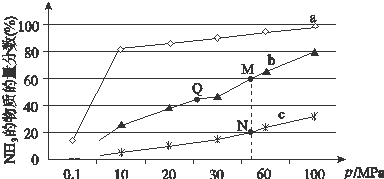
题目内容
17.下列物质中不能与NaOH溶液反应的是( )| A. | Na | B. | FeCl3 | C. | Al | D. | Cu |
分析 钠与溶液中溶剂水反应;氢氧化钠与氯化铁反应生成氢氧化铁;铝与氢氧化钠反应生成偏铝酸钠和氢气;铜与氢氧化钠不反应,由此分析解答.
解答 解:A、钠与溶液中溶剂水反应,不符合条件,故A不选;
B、氢氧化钠与氯化铁反应生成氢氧化铁和氯化钠,不符合条件,故B不选;
C、铝与氢氧化钠反应生成偏铝酸钠和氢气,不符合条件,故C不选;
D、铜与氢氧化钠不反应,符合条件,故D选;
故选D.
点评 本题主要考查单质及化合物性质,难度较小,注意金属铝既能与酸又能与碱反应的物质.

练习册系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 氯化钙溶液中通入CO2气体 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl${\;}^{_}$+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | Ca(ClO)2溶液中通人过量的SO2气体:Cl-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| D. | 向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4+AlO${\;}_{2}^{-}$+H2O |
12.当前我国环境状况不容乐观,其中PM2.5、CO、S02、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义.
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如表:
根据表中数据计算该试样的pH=_3
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示.
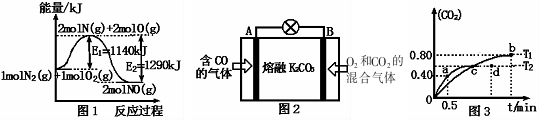
①写出N2和02反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=-150kJ•mol-1.
②有人设想将C0按下列反应除去:2CO(g)═2C(s)+02(g)△H>O,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0
③用图2所示原电池原理也可以除去CO,则其负极反应式为:CO+CO32--2e-=2CO2.
(3)有人设想利用反应NaOH+S02═NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生.再生的离子方程式为:HSO3-+OH-+Ca2+═CaSO3↓+H2O.
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)-5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$.
②T1与T2化学平衡常数大小关系:K(T1)>K(T2)(填“>”、“<”或“=”)
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样中的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化如图1所示.

①写出N2和02反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=-150kJ•mol-1.
②有人设想将C0按下列反应除去:2CO(g)═2C(s)+02(g)△H>O,请你分析该设想能否实现?否(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0
③用图2所示原电池原理也可以除去CO,则其负极反应式为:CO+CO32--2e-=2CO2.
(3)有人设想利用反应NaOH+S02═NaHS03将SO2吸收除去,然后用石灰水又可使NaOH再生.再生的离子方程式为:HSO3-+OH-+Ca2+═CaSO3↓+H2O.
(4)利用I205消除CO污染的反应为:5CO(g)+I205(s)-5CO2(g)+I2(s),不同温度下,测得CO2的体积分数随时间t变化曲线如图3.则:
①该反应的化学平衡常数表达式为K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$.
②T1与T2化学平衡常数大小关系:K(T1)>K(T2)(填“>”、“<”或“=”)
2.短周期元素甲、乙、丙、丁的原子序数依次增大.甲的最高价氧化物与乙的氢化物同时通入水中,得到的生成物既可与酸反应又可与碱反应.丙位于ⅠA族,丁原子的核外电子总数是其最外层电子数的3倍.下列说法中正确的是( )
| A. | 气态氢化物的稳定性:乙<丁 | |
| B. | 原子半径:甲<乙 | |
| C. | 丙的两种氧化物都是离子化合物 | |
| D. | 甲、乙、丁的最高价氧化物对应的水化物的酸性依次增强 |
9.某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4LH2(标准状况),下列说法错误的是( )
| A. | 该醇是乙二醇 | B. | 该羧酸有3种同分异构体 | ||
| C. | 该羧酸的官能团含有羟基和羧基 | D. | 羧酸的分子式是C3H6O3 |
6.下列化学反应对应的离子方程式书写正确的是( )
| A. | 1-氯丙烷中加NaOH溶液后加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| B. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
7.将氯气通入NaOH溶液发生反应Cl2+2NaOH═NaCl+NaClO+H2O,Cl2+H2O=HCl+HClO,若溶液呈中性下列说法正确的( )
| A. | 溶液中存在6种微粒 | |
| B. | c(Na+)=c(HClO)+2c(ClO-) | |
| C. | c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| D. | 往所得中性溶液中加入NaHCO3能放出大量气体 |